L’équipe de recherche « Cell adhesion and Mechanics » (Institut Jacques Monod, Université Paris Cité et CNRS UMR 7592), conduite par le Dr. B. Ladoux et le Dr. Mège à l’institut Jacques Monod, a utilisé des hydrogels mous pour moduler la rigidité du support cellulaire dans des gammes proches de celles rencontrées in vivo par les tissus. À la surprise des chercheurs, et alors que les cellules épithéliales continuent de se diviser pour former une fine couche de tissu éponyme, les chercheurs ont montré que des fractures apparaissent et disparaissent spontanément au sein du tissu épithélial et que ces fractures dépendent de la rigidité du substrat. Les résultats de leurs travaux, publiés dans la revue Nature Physics, proposent un mécanisme physique pour expliquer la formation de ces fractures.
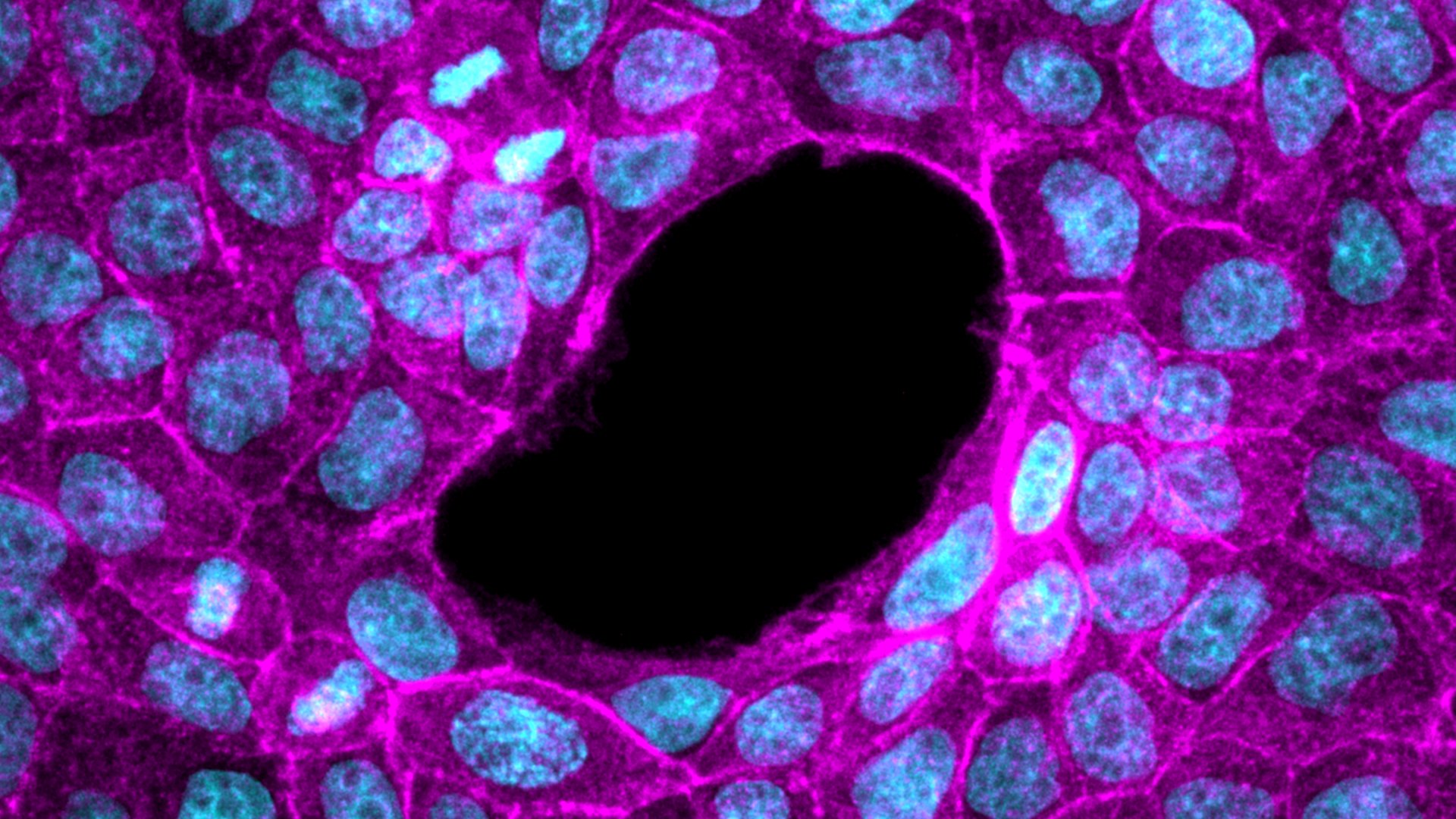
© Lakshmi Balasubramaniam et Surabhi Sonam
La plupart des cellules de mammifères sont des cellules dites adhérentes qui réagissent aux propriétés mécaniques de leur environnement et notamment à la rigidité du substrat sur lequel elles adhèrent. Cette réaction est si importante, que la nature souple ou rigide du substrat sur lequel elles adhèrent modifie leurs propriétés internes. Un étude pionnière menée par le groupe du Pr. Discher (Engler et al. Cell 2006) a notamment déterminé que des cellules souches, donc encore indifférenciées et possédant toutes les mêmes propriétés de départ, se différencient en types cellulaires distincts selon la rigidité des substrats sur lesquels elles sont placées. Par exemple, sur un substrat mou, elles se spécialisent en neurones, sur un substrat de rigidité moyenne, en cellules musculaires et sur substrat rigide en cellules osseuses. Ceci signifie que la façon dont les cellules perçoivent leur environnement mécanique, à travers les forces qu’elles exercent dessus, peut même influencer leur expression génétique. Ce domaine est aujourd’hui étudié sous le nom de mécanobiologie.
Les études menées par l’équipe conduite par le Dr Ladoux et le Dr Mège s’inscrivent dans ce contexte. En effet, les organes sont protégés par de fines couches de cellules appelées tissus épithéliaux. Cette couche de tissu épithélial a un rôle majeur dans la protection des organes. On comprend dès lors que le maintien de l’intégrité de cette couche est important à préserver.
L’équipe de recherche, en collaboration avec un groupe de théoriciens du CNRS de l’Université Aix Marseille mené par Dr. Rupprecht, avec des chercheurs de l’Institut Curie, de l’ESPCI et de l’Université Nationale de Singapour, a donc étudié les propriétés biologiques et physiques de ces ensembles cellulaires. Dans ces derniers, les cellules sont connectées les unes aux autres via des jonctions intercellulaires, ce qui explique que les propriétés émergentes de ces cellules sont régies par des mécanismes collectifs.
In vivo les cellules sont sur des substrats plutôt mous (rigidité semblable à de la gélatine) par rapport aux substrats traditionnellement utilisés pour les cultures cellulaires classiques in vitro. L’équipe de recherche a donc cultivé ces assemblées cellulaires sur des hydrogels mous (un million de fois plus mou que le plastique) pour mimer les conditions in vivo et faire varier à loisir la rigidité du support cellulaire.
Ils ont ainsi pu montrer que les cellules épithéliales étudiées en monocouches sur des substrats mous forment spontanément des trous alors que ce phénomène n’est pas observé sur des substrats rigides. En effet, en étudiant les propriétés mécaniques de ces cellules, ils ont pu mettre en évidence que les cellules étaient sous compression sur des substrats rigides et sous tension sur des substrats mous, ces états de tension étant à même de générer des fractures dans les monocouches.
Ils ont alors cherché à comprendre comment ces trous se forment sur les substrats mous, et ont constaté que les cellules dans les tissus épithéliaux ont une forme allongée et ont tendance à s’aligner régulièrement les unes par rapport aux autres selon des principes similaires à des systèmes physiques bien connus que sont les cristaux liquides. Les cristaux liquides font référence à des états de la matière à mi-chemin entre liquide et solide. Les molécules composant les cristaux liquides nématiques ont une forme cylindrique allongée. Dans un tel système, l’ordre naît de l’orientation à longue portée des molécules dans une direction privilégiée. Cependant, dans certaines situations, des défauts d’alignement apparaissent et génèrent des inhomogénéités, appelées défauts topologiques. À la différence des systèmes passifs, les cellules constituent des systèmes actifs qui peuvent donc s’auto-organiser et se mouvoir les unes par rapport aux autres. Ce mouvement spontané des cellules peut alors introduire des défauts topologiques d’organisation dans les monocouches, similaires à ceux observés dans les cristaux liquides. En poursuivant cette analogie avec des modèles expérimentaux et théoriques, les chercheurs ont pu montrer que ces défauts topologiques étaient les sites d’émergence de fortes fluctuations de tension devenant ainsi des sites privilégiés pour nucléer des fractures dans les épithéliums.
Ces études in vitro ont permis de mettre en évidence des propriétés importantes liées au maintien de l’intégrité des tissus et de montrer comment la mécanique peut expliquer certains processus biologiques. Ce travail ouvre de nouvelles perspectives d’études en permettant d’appréhender de façon plus complète l’environnement cellulaire en incluant désormais le rôle de la tension mécanique dans la régulation physiologique des tissus épithéliaux et de la morphogénèse.
L’équipe de recherche poursuit ses études sur des organoïdes, ce qui complète davantage encore la compréhension globale des phénomènes puisque les cellules sont environnées d’autres cellules de nature et fonctionnalité différentes et donc aux influences multiples.
Références
Mechanical stress driven by rigidity sensing governs epithelial stability
Surabhi Sonam, Lakshmi Balasubramaniam, Shao-Zhen Lin, Ying Ming Yow Ivan, Irina Pi-Jaumà, Cecile Jebane, Marc Karnat, Yusuke Toyama, Philippe Marcq, Jacques Prost, René-Marc Mège, Jean-François Rupprecht & Benoît Ladoux
Nature Physics , doi.org/10.1038/s41567-022-01826-2
Organoïde : micro-tissu multicellulaires en trois dimensions (3D) dérivés de cellules souches et conçu pour imiter la structure et la fonctionnalité complexes d’un organe. Pour autant, un organoïde n’est pas un organe complet en miniature. Étant incomplet du point de vue de sa composition, isolé des autres organes, non vascularisé par un réseau sanguin, … il constitue un modèle proche de l’organe, et constitue une très bonne alternative au recours au modèle animal à des fins scientifiques.
À lire aussi
Prix des meilleurs mémoires de la Graduate School Sustainability, Organisations and Institutions : valoriser l’excellence scientifique en soutenabilité
La Graduate school Sustainability, Organisations and Institutions a organisé sa traditionnelle cérémonie de remise de Prix des meilleurs mémoires de ses étudiantes et étudiants. Une distinction valorisant l’excellence scientifique des recherches consacrées au développement durable et à la soutenabilité. Découvrez les trois lauréates et lauréats récompensés pour la qualité de leurs travaux.

La semaine du cerveau 2026 à l’Université Paris Cité

Prix Jeunes Talents France L’Oréal-UNESCO Pour les Femmes et la Science : Appel à candidatures 2026
La Fondation L'Oréal, en partenariat avec la Commission nationale française pour l'UNESCO et l'Académie des sciences, déclare officiellement ouvert l'appel à candidatures de l'édition 2026 du Prix Jeunes Talents France L'Oréal-UNESCO Pour les Femmes et la Science :...

Suivi des maladies chroniques : un patient sur deux serait ouvert à la téléconsultation
L’étude REACTIVE, coordonnée par la Dre Tiphaine Lenfant et le Pr Viet-Thi Tran et menée par des équipes de médecine interne de l’hôpital européen Georges-Pompidou AP-HP, du centre d’épidémiologie clinique de l’hôpital Hôtel-Dieu AP-HP, de l’Université Paris Cité, de...
