Grâce à une étude multicentrique, les chercheurs de l’équipe Systèmes Intelligents de Perception dirigée par le Pr N. Loménie, au LIPADE (Université Paris Cité), ont apporté la preuve que les outils d’Intelligence Artificielle (IA), lorsqu’ils sont correctement entraînés, arrivent à classer les tumeurs cancéreuses et à prédire l’effet d’un traitement d’immunothérapie sur ces dernières. Pour cela, l’équipe de chercheurs a appris aux algorithmes à analyser des lames histopathologiques numérisées, images haute résolution, contenant plusieurs gigaoctets de données pour chaque patient. Loin de supplanter l’Homme, l’IA permet de gagner un temps précieux pour poser un diagnostic, proposer le traitement le plus adapté et fournira de nouvelles informations que les biologistes et médecins devront apprendre à interpréter et qui compléteront et affineront les savoirs sur ces pathologies.
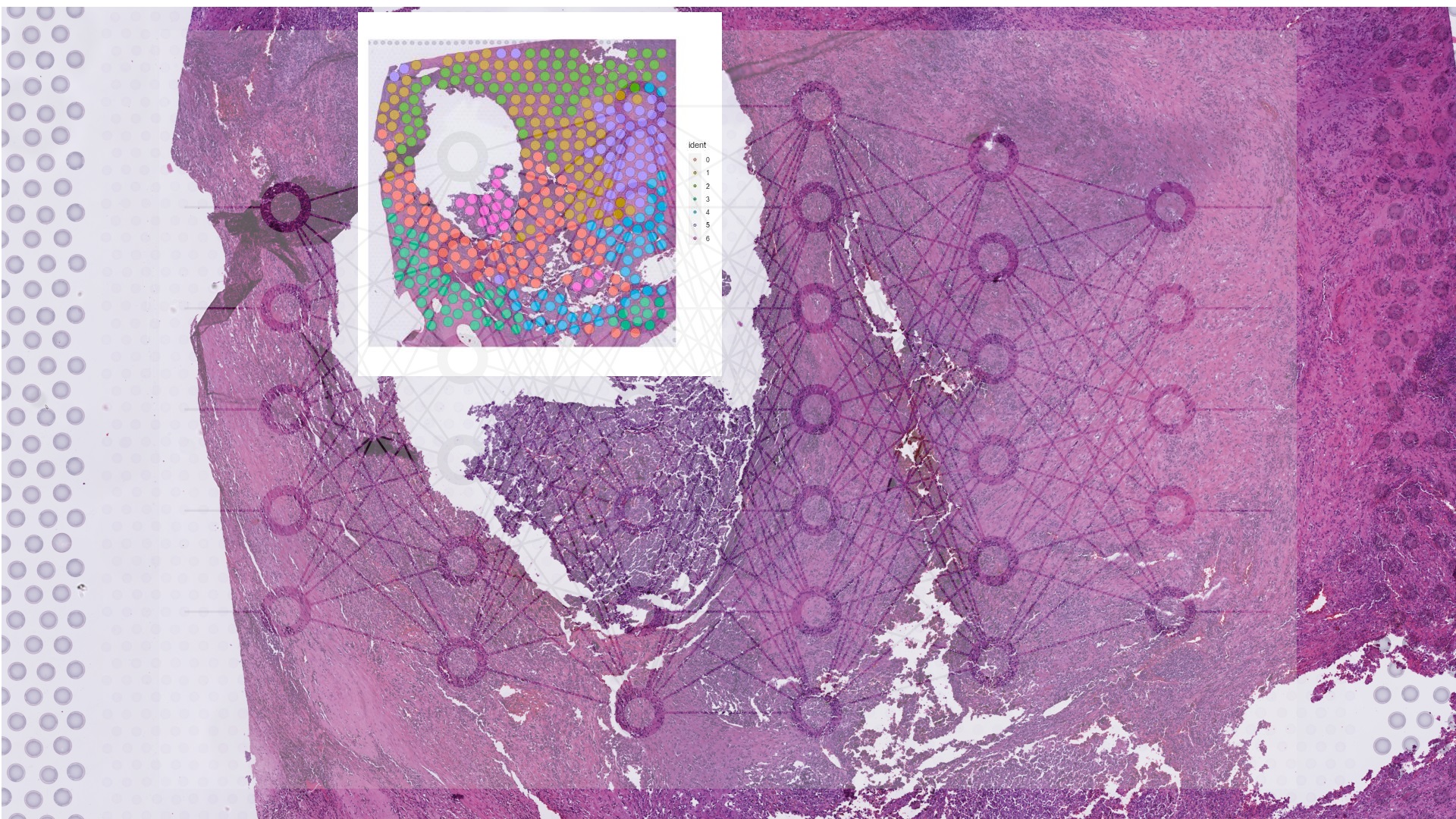
Prédiction de signature génique sur image de tissu par IA
© Nicolas Loménie
Les puissances de calcul à notre disposition aujourd’hui permettent d’analyser très rapidement d’immenses quantités de données. Des chercheurs en informatique, en biologie et des médecins se sont emparés depuis quelques années de cet outil pour le mettre à la disposition de notre santé.
Une équipe d’enseignants-chercheurs dirigée par le Pr N. Lomémie, au LIPADE, s’intéressant aux difficultés d’identifier les tumeurs cancéreuses du foie susceptibles de bien répondre au traitement d’immunothérapie, ont mis au point et conduit, en collaboration avec le Pr Julien Calderaro et une doctorante Qinghe Zeng, une étude multicentrique permettant d’entraîner les algorithmes à analyser, en un temps très réduit, une grande quantité de données histologiques provenant de biopsies de tumeurs d’anciens patients.
Comment rendre des algorithmes intelligents ?
En leur apprenant à explorer les images haute résolution de lames histopathologiques numérisées, contenant plusieurs gigaoctets de données pour chaque patient.
À force de travail d’analyse computationnelle de ces images, les algorithmes apprennent à y détecter des zones tumorales, des lymphocytes (mais aussi de façon agnostique d’autres éléments phénotypiques de lame) par apprentissage auto-supervisé, autant d’éléments qui étaient pour la plupart détectés à l’œil nu jusqu’à maintenant mais qui pourront, plus tard, être détectés plus vite et plus précisément par l’IA.
L’étude conduite ici, dite rétrospective, utilise les lames histopathologiques d’anciens patients, conservées depuis des années, et ce dans plusieurs pays (étude multicentrique) de façon à entraîner les algorithmes à travailler sur des lames élaborées avec des méthodologies, des colorations diverses permettant ainsi de générer des algorithmes utilisables partout avec la même précision.
Ces analyses rétrospectives permettent aujourd’hui aux chercheurs de constituer de grandes bases de données, inventoriant et classant les données histologiques et les associant à des données génétiques de ces anciens patients, pour lesquels on connaît le traitement qu’ils ont reçu et avec quel succès ou effet néfaste ils ont réagi. Il est donc maintenant possible de classer les typologies de tumeurs et de les associer au traitement auquel chaque typologie a réagi positivement. Ces nouvelles informations, issues de milliers de données, conduisent à des calculs statistiques de plus en plus fiables sur lesquels les médecins vont pouvoir s’appuyer.
Par exemple, dans le cas des tumeurs cancéreuses du foie, il est possible de proposer à certains patients un traitement d’immunothérapie association atezolizumab-bévacizumab. La difficulté réside dans le fait que ce traitement n’est efficace que sur un petit nombre de patients. Pour les autres, il est non seulement peu efficace mais il engendre nombre d’effets secondaires notables voir mortels. En comparant les lames histopathologiques de biopsies de tumeurs du foie de patients actuels avec celles déjà inventoriées, il devient possible d’identifier rapidement les patients qui répondront bien à ce traitement d’immunothérapie.
La constitution de ces bases de données poursuit plusieurs objectifs. Le premier est de permettre, dans les plus courts délais, la mise en place du traitement le plus adapté, ce qui tend vers une médecine personnalisée. Le deuxième est de trouver, grâce aux analyses des lames faites par l’IA, de nouveaux éléments biologiques communs à plusieurs patients qui permettront de créer des profils de patients qui deviendront autant de références auxquelles comparées les nouveaux patients.
Ces lames histopathologiques numérisées contenant de très grandes quantités de données, il est très probable que l’IA saura y détecter de nouveaux éléments que les biologistes et médecins devront apprendre à interpréter et qui compléteront et affineront les savoirs sur ces pathologies.
Références
Artificial intelligence-based pathology as a biomarker of sensitivity to atezolizumab–bevacizumab in patients with hepatocellular carcinoma: a multicentre retrospective study, The Lancet Oncology, Novembre 2023
À lire aussi

Appel à candidatures 2024 Université Paris Cité et King’s College London
L’Université Paris Cité et le King’s College de Londres lancent un appel à projets de recherche conjoints pour promouvoir et renforcer les collaborations entre leurs chercheurs et chercheuses. Thématiques de recherche Le présent appel est ouvert à toutes les...

La consommation de certains additifs alimentaires émulsifiants serait associée à un risque accru de diabète de type 2
Les émulsifiants sont parmi les additifs les plus fréquemment utilisés par l’industrie agroalimentaire. Leur usage vise à améliorer la texture des produits tout en prolongeant leur durée de conservation. Des chercheurs et des chercheuses de l’Inserm,...
Theileria annulata et Cancer : une stratégie du parasite dévoilée !
L’équipe de recherche du Pr Jonathan Weitzman a mis en lumière le mécanisme par lequel le parasite Theileria annulata, responsable de maladies semblables aux cancers chez les bovins, échappe au mécanisme de défense de la cellule hôte.

Université Paris Cité félicite le professeur Anton Zorich pour l’obtention de son ERC Advanced Grant
ERC Advanced Grant 2023 : le professeur Anton Zorich, mathématicien à l’université Paris Cité compte parmi les 37 lauréates et lauréats français.
