Une étude issue d’une collaboration internationale, coordonnée par Nicolas Panayotis, chercheur au Saints-Pères Institute for the Neurosciences (SPPIN – CNRS/Université Paris Cité) met en lumière un rôle inattendu de l’importine β1 dans le fonctionnement des synapses et la mémoire. Les résultats, publiés dans la revue Science Signaling le 20 janvier 2026, montrent l’importance de cette protéine de transport dans le maintien de la physiologie présynaptique, en particulier dans l’hippocampe.
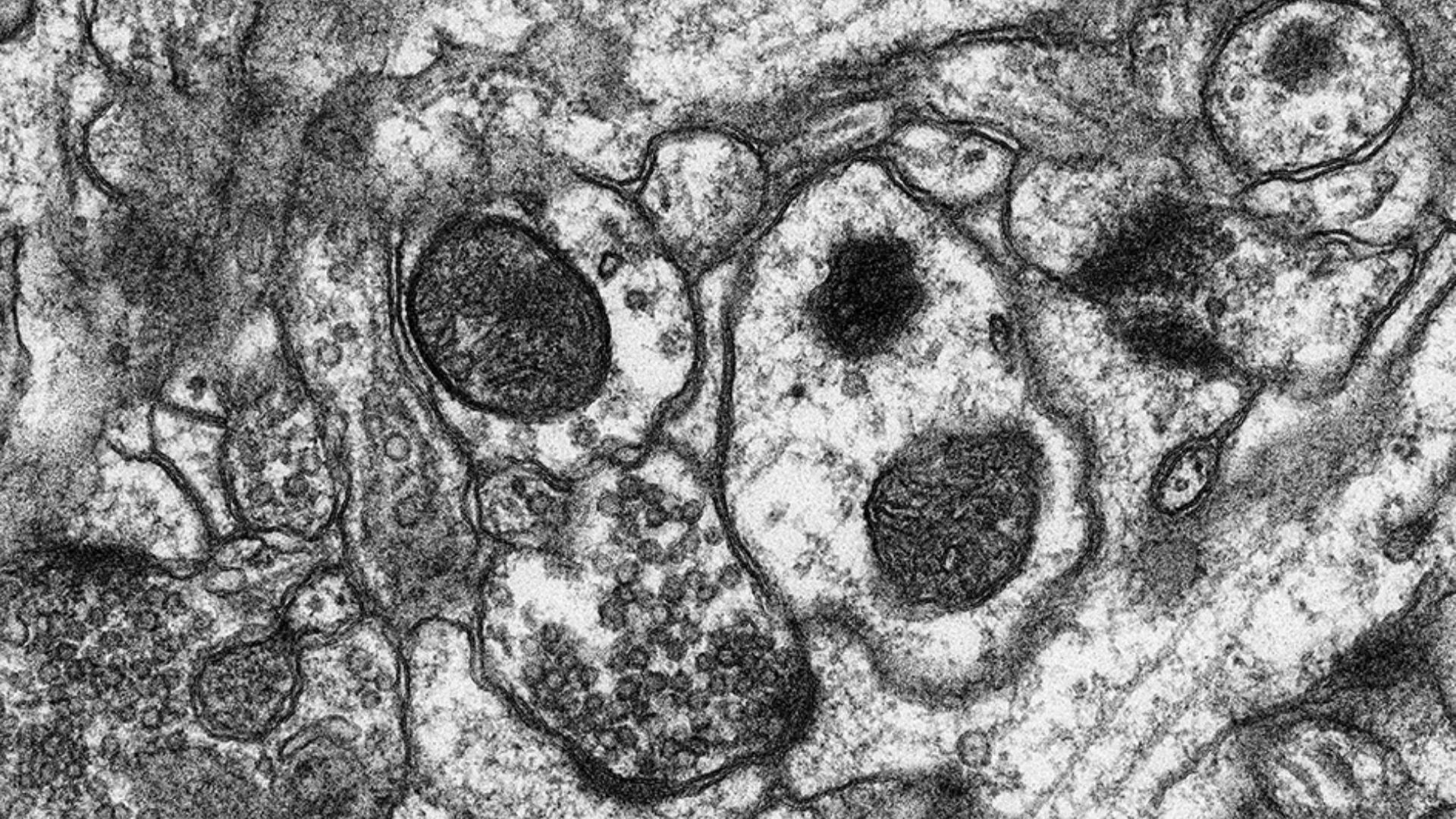
Image de microscopie électronique à transmission sur tranche d’hippocampe de souris, permettant l’analyse des synapses des fibres moussues.
© Leilah Otikovs/Philip Freund
Une protéine de transport au cœur de la mémoire
Les neurones sont des cellules très polarisées, formées de deux parties très différentes, avec d’une part, le corps cellulaire (ou soma) et les dendrites, et d’autre part, les axones qui peuvent s’étendre sur de très longues distances. Pour assurer une transmission synaptique efficace, certaines protéines doivent être produites localement, au niveau des synapses, grâce à la traduction sur place d’ARN messagers (ARNm) transportés le long de l’axone.
Les mécanismes qui régulent cette localisation et cette traduction restent toutefois encore mal compris. Les chercheurs ont étudié un modèle murin dans lequel la région 3’UTR de l’ARNm de l’importine β1, un élément indispensable à sa localisation axonale, est absente. Ces souris présentent des déficits marqués de la mémoire spatiale et contextuelle dépendante de l’hippocampe.
Un déficit présynaptique ciblé dans les fibres moussues de l’hippocampe
Des enregistrements électrophysiologiques menés sur des tranches d’hippocampe révèlent une altération sélective d’une forme présynaptique de plasticité à long terme au niveau des fibres moussues, tandis que d’autres voies hippocampiques, comme les collatérales de Schaffer, restent intactes.
Des approches combinant culture de neurones hippocampiques, microfluidique, imagerie et biochimie montrent que l’absence de la région 3’UTR de l’ARNm de l’importine β1 entraîne sa redistribution vers le soma neuronal, réduisant sa disponibilité dans les terminaisons présynaptiques. Des analyses protéomiques et phosphoprotéomiques de synaptosomes hippocampiques, structures contenant exclusivement les terminaisons neuronales, mettent en évidence un remaniement majeur de la composition et de la signalisation des protéines présynaptiques, notamment au niveau de voies impliquées dans la synthèse protéique locale.
La traduction locale comme mécanisme clé
Grâce à une approche innovante de RiboTag-Seq, les chercheurs ont pu isoler, à partir de synaptosomes spécifiques des fibres moussues, les ARN transcrits en cours de traduction, déjà associés à la machinerie ribosomale.
L’analyse bio-informatique de ces données de RNA-seq révèle que l’absence de localisation axonale de l’importine β1 s’accompagne d’une diminution de la traduction locale de transcrits codant pour des composants structuraux de la synapse. Ces altérations sont également associées à une réduction du pool de vésicules synaptiques immédiatement mobilisables, ce qui pourrait affaiblir la communication entre neurones. Ce déficit a été confirmé par des analyses en microscopie électronique ainsi que par des enregistrements électrophysiologiques sensibles à l’intégrité de ce pool vésiculaire.
Ces travaux élargissent la compréhension des liens entre synthèse protéique locale, plasticité présynaptique et mémoire. Ils ouvrent également de nouvelles perspectives pour explorer la manière dont certaines protéines de transport, longtemps considérées comme « ménagères », peuvent interagir avec des protéines liant l’ARN afin de contrôler finement la fonction synaptique.
À plus long terme, les chercheurs envisagent d’étudier l’implication et le rôle de la perturbation de la localisation subcellulaire de l’importine β1 dans le développement des troubles mnésiques.
Un effort collaboratif international
Ce travail est le fruit d’une collaboration étroite entre plusieurs équipes internationales aux expertises complémentaires incluant le groupe du Pr Mike Fainzilber au Weizmann Institute of Science (Israël), où le Dr Nicolas Panayotis a mené ces recherches avec Philip Freund avant d’ouvrir son équipe au SPPIN (CNRS/Université Paris Cité). Les analyses au niveau des circuits hippocampiques et les enregistrements électrophysiologiques ont été réalisés par l’équipe du Pr Michael Kreutz au Leibniz Institute for Neurobiology (Magdebourg, Allemagne). Enfin, les approches de protéomique et de RNA-seq ont bénéficié d’apports essentiels des équipes du Pr Alma Burlingame (UCSF) et du Pr Riki Kawaguchi (UCLA), aux États-Unis.
Cette synergie a permis de combiner des approches allant du niveau moléculaire et cellulaire jusqu’aux circuits neuronaux et aux comportements chez la souris, offrant ainsi une compréhension multi-échelle qui ne pourrait être atteinte au sein d’un seul laboratoire.
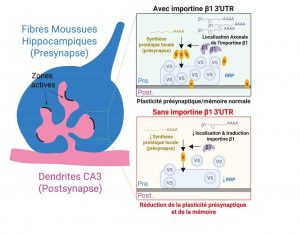
Ci-dessus : Mécanismes reliant l‘absence d’importine β1 axonale à une altération de la mémoire spatiale via un dysfonctionnement présynaptique. La réduction de la mémoire spatiale et contextuelle des souris importine β1 Δ3’UTR se traduit par une altération de la plasticité présynaptique des fibres moussues de l’hippocampe (en bleu sur le dessin à gauche) et une réduction du pool de vésicules synaptiques (VS) prêtes à être libérées (Readily Releasable Pool, RRP). Les résultats de l’étude montrent que ces dysfonctionnements synaptiques sont dus à une réduction de la synthèse locale de protéines synaptique (bulles jaunes/S) dans le bouton (présynaptique) des fibres moussues et d’une altération du phospho-protéome synaptique. Ainsi, l’importine β1 apparait comme un régulateur de la synthèse protéique locale des ARNm axonaux dans l’hippocampe. © Nicolas Panayotis & Philip Freund
Référence
Subcellular depletion of importin β1 impairs presynaptic local translation and spatial memory
Freund, P.A., Panayotis, N et al.
Science Signaling, 2026 | DOI: 10.1126/scisignal.ady2026
À lire aussi

Comment les microbes protègent de l’allergie
Une étude menée par des scientifiques de l'Institut Pasteur, organisme de recherche partenaire de l’Université Paris Cité, révèle que les microbes protègent le poumon contre le développement ultérieur d'allergies et d'asthme. Cette protection durable est « mémorisée »...
lire plus
Prix des meilleurs mémoires de la Graduate School Sustainability, Organisations and Institutions : valoriser l’excellence scientifique en soutenabilité
La Graduate school Sustainability, Organisations and Institutions a organisé sa traditionnelle cérémonie de remise de Prix des meilleurs mémoires de ses étudiantes et étudiants. Une distinction valorisant l’excellence scientifique des recherches consacrées au développement durable et à la soutenabilité. Découvrez les trois lauréates et lauréats récompensés pour la qualité de leurs travaux.
lire plus
La semaine du cerveau 2026 à l’Université Paris Cité

Prix Jeunes Talents France L’Oréal-UNESCO Pour les Femmes et la Science : Appel à candidatures 2026
La Fondation L'Oréal, en partenariat avec la Commission nationale française pour l'UNESCO et l'Académie des sciences, déclare officiellement ouvert l'appel à candidatures de l'édition 2026 du Prix Jeunes Talents France L'Oréal-UNESCO Pour les Femmes et la Science :...
lire plus