Dans une récente étude conduite par des chercheurs de plusieurs unités de recherche d’université Paris Cité (UMR7216 CNRS Épigénétique et destin cellulaire ; UMR1141 Inserm Neurodiderot, UMR8251 Biologie fonctionnelle et adaptative) et dirigée par Valérie Mezger, directrice de l’unité Épigénétique et Destin Cellulaire (UMR7216 – Université Paris Cité / CNRS), les équipes de recherche ont exploré les mécanismes moléculaires impliqués lors du neurodéveloppement du cerveau. Durant ce dernier, les cellules en développement peuvent être soumises à des stress cellulaires dus à des agressions extérieures ou à des mutations génétiques. Les chercheurs se sont ici particulièrement intéressés à une voie de réponse au stress cellulaire, dérégulée dans divers troubles neurodéveloppementaux (TND). Les résultats de leurs travaux ont permis de montrer, qu’en dépit de leur hétérogénéité, les TND partagent un socle commun de mécanismes pathologiques dont des modifications des modes d’action et d’interaction moléculaire qui altèrent cette voie de régulation et perturbent simultanément les mécanismes de contrôle des gènes gouvernant le neurodéveloppement.
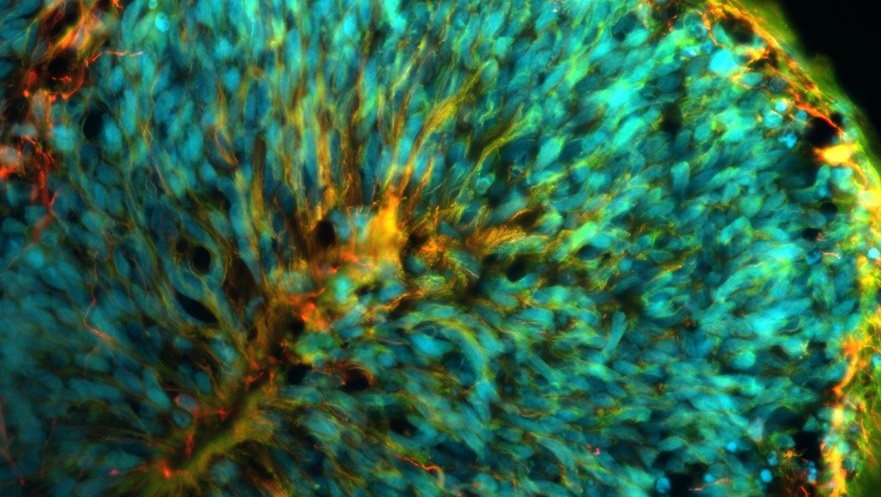
Structure présente dans un organoïde cérébral et ressemblant à un cortex cérébral en développement.
© Kevin Daupin, Doctorant Université Paris Cité
Le développement embryonnaire est un moment de grande vulnérabilité dû aux complexes réarrangements cellulaires et moléculaires qui se produisent. Durant cette période, le développement du cerveau est particulièrement sensible aux stress, que ces derniers soient d’origine génétique ou environnementaux, c’est-à-dire liés à des agressions in utero comme l’exposition à des toxiques (dont l’alcool), à des infections (virales ou bactériennes) ou au stress psychologique chez la mère. Les troubles du neurodéveloppement sont donc nombreux et variés.
Il existe entre 200 et 300 maladies liées à des troubles neurodéveloppementaux (TND) et environ 10% des enfants en sont affectés. Alors que les TND sont une cause majeure de handicap à vie qui engendre un fort coût humain, sociétal et économique, la recherche sur les TND fait face à plusieurs défis qui entravent à la fois l’identification de mécanismes moléculaires fondamentaux et le développement de stratégies thérapeutiques : la grande diversité des TND, la variabilité des tableaux cliniques pour une même TND (voire causée par un même gène), la complexité des mécanismes qui contrôlent le neurodéveloppement et l’impossibilité d’avoir un accès expérimental au cerveau en développement.
L’équipe de chercheurs, dirigée par Valérie Mezger, a contribué à redéfinir le cadre conceptuel des études sur les troubles neurodéveloppementaux en montrant qu’en dépit de leur hétérogénéité, les TND partagent un socle commun de mécanismes pathologiques : d’une part, des perturbations du paysage épigénétique (qui dicte l’accessibilité à la chromatine qui contient l’information génétique) et, d’autre part, une dérégulation des voies de réponse au stress cellulaire.
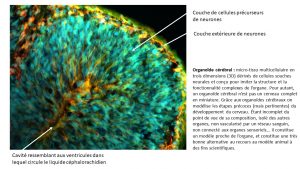
Pour conduire ses travaux, l’équipe de chercheurs a utilisé des organoïdes cérébraux[1], et participé avec les équipes de Valérie DOYE et Vanessa RIBES de l’Institut Jacques Monod (UMR7592) à créer la plateforme enSCORE financée par le Labex Who am I ? et destinée à accompagner les équipes dans le production d’organoïdes cérébraux. Ainsi, les chercheurs ont pu, sans recourir à un modèle animal pré-clinique, étudier de façon précise et en contexte ce qui se passe aux stades les plus précoces du neurodéveloppement de notre cerveau, à savoir lors de la mise en place des cellules souches neurales appelées cellules pro-génitrices neurales qui évolueront ensuite pour se transformer en neurones, entre autres. En effet, à ces stades aussi précoces de développement, des dommages peuvent intervenir et avoir des conséquences à long terme.
L’équipe s’est alors concentrée sur les mécanismes moléculaires, dans le cerveau, qui contrôlent non seulement les gènes qui gouvernent le neurodéveloppement du cerveau mais aussi qui permettent aux cellules de récupérer après un stress. Ces mécanismes moléculaires sont appelés voie de régulation. (Il en existe bien d’autres dans le reste de l’organisme). En conditions normales, cette voie de régulation s’occupe, de façon inattendue, prioritairement des gènes qui régulent le développement du cerveau. Mais en cas de stress cellulaire subi par cet organe en développement, cette voie se détourne de cette mission principale, pour s’occuper de la régulation des mécanismes de récupération et de survie des cellules après qu’elles ont été soumises à cette agression.
L’équipe de recherche a mis en évidence que cette voie de régulation est endommagée dans plusieurs cas de maladies liées à des troubles neurodéveloppementaux, quelle que soit l’origine génétique ou environnementale de ces TND. Par des approches de biophysique, de biochimie, de modélisation structurale et de biologie cellulaire, les auteurs ont mis en évidence une cascade moléculaire (CBP/EP300-HSF2-N-cadhérine) dérégulée dans une TND rare, le syndrome de Rubinstein-Taybi (RSTS), causée par une mutation des gènes CBP/ EP300.
Pour explorer l’importance de cette cascade moléculaire dans le neurodéveloppement, les chercheurs ont utilisé des cellules de tissus périphériques (sang, peau…) de patients RSTS. Ils ont ainsi, dans le cadre de protocoles strictement réglementés sur le plan éthique, reprogrammé ces cellules en cellules souches pluripotentes qu’ils ont pu différencier en organoïdes cérébraux humains qui miment les premières étapes du neurodéveloppement. Ce procédé leur a permis de montrer, dans cette maladie, qu’une protéine clé gouvernant la réponse au stress cellulaire, mais aussi des familles de gènes contrôlant le neurodéveloppement, est dégradée suite à la mutation des gènes CBP/EP300. La diminution de cette protéine engendre la perturbation simultanée de certains mécanismes de contrôle des gènes gouvernant le neurodéveloppement mais aussi des mécanismes de récupération post-agression. [En savoir plus]
Les résultats de cette étude ont permis à l’équipe de recherche de redéfinir le cadre conceptuel des études sur les troubles neurodéveloppementaux en montrant qu’en dépit de leur hétérogénéité, des TND partagent un socle commun de mécanismes pathologiques : une dérégulation des voies de réponse au stress cellulaire.
En modélisant ainsi une TND qui combine des perturbations épigénétiques et des perturbations de la voie de régulation de réponse au stress cellulaire que l’on retrouve dans plusieurs TND d’origine génétique ou environnementale, l’équipe a créé un modèle qui permet d’envisager d’utiliser cette voie de régulation pour trouver des voies thérapeutiques communes à plusieurs maladies neurodéveloppementales.
En savoir plus : Si dans le cas de l’étude conduite ici, l’altération de la voie de régulation de réponse au stress cellulaire est due à la mutation génétique d’une protéine (ici, CBP ou EP300) directement impliquée dans cette voie, dans beaucoup d’autres cas, les mutations génétiques (même monogéniques) ne concernent pas directement une protéine directement impliquée dans cette voie de régulation (il n’y a pas de mutations des acteurs moléculaires qui régissent ou modulent directement cette voie). En effet, toute protéine mutée est susceptible non seulement d’engendrer des perturbations liées à la perte ou à un gain de sa fonction causée par la mutation, mais aussi de perturber ses interactions avec un grand nombre de protéines, que ce soit par perte d’interaction avec certains de ses partenaires protéiques habituels et/ou par gain, néfaste, d’interaction avec d’autres protéines de la cellule. C’est donc l’équilibre entre un grand nombre de protéines (« homéostasie protéique » ou « protéostasie ») et leurs interactions (interactome) qui est bouleversé dans la cellule, ce qui est connu pour déclencher une altération de l’activité de la voie de réponse au stress. Ces perturbations touchent donc potentiellement et simultanément à la fois les mécanismes de récupération post-agression, mais aussi les mécanismes de contrôle des gènes gouvernant le neurodéveloppement.
L’épigénétique – Nous héritons tous d’un patrimoine génétique, nos gènes, que nous conservons toute notre vie. Ce patrimoine génétique est présent dans toutes nos cellules mais ne se manifeste pas de la même façon partout. Les cellules du cœur sont différentes de celles de la peau, du foie, du cerveau… et cette différence vient du fait que les gènes ne sont pas tous actifs partout et en même temps. Dans les cellules de la peau, certains gènes sont actifs d’autres pas. Dans les cellules du cœur, ce sont d’autres gènes qui s’activent. Ces activations ou inactivations de gènes sont dues à des modifications de l’environnement des gènes : les marques épigénétiques. Ces dernières sont à l’origine de modifications de l’accessibilité à l’information génétique dans la cellule, donc de l’activité des gènes, et donc du fonctionnement des cellules. Ces marques épigénétiques étant elles-mêmes influencées par notre alimentation, nos habitudes de vie, notre environnement, les traitements médicamenteux que nous recevons… l’ensemble des influences environnementales au cours de la vie crée, pour chacun, une histoire épigénétique complexe.
À lire aussi

La semaine du cerveau 2026 à l’Université Paris Cité

Prix Jeunes Talents France L’Oréal-UNESCO Pour les Femmes et la Science : Appel à candidatures 2026
La Fondation L'Oréal, en partenariat avec la Commission nationale française pour l'UNESCO et l'Académie des sciences, déclare officiellement ouvert l'appel à candidatures de l'édition 2026 du Prix Jeunes Talents France L'Oréal-UNESCO Pour les Femmes et la Science :...
lire plus
Suivi des maladies chroniques : un patient sur deux serait ouvert à la téléconsultation
L’étude REACTIVE, coordonnée par la Dre Tiphaine Lenfant et le Pr Viet-Thi Tran et menée par des équipes de médecine interne de l’hôpital européen Georges-Pompidou AP-HP, du centre d’épidémiologie clinique de l’hôpital Hôtel-Dieu AP-HP, de l’Université Paris Cité, de...
lire plus
Le Collège de l’Académie nationale de médecine : une première promotion marquée par l’engagement de l’Université Paris Cité
Créé en décembre 2024, le Collège de l’Académie nationale de médecine se veut être un lieu d’échanges entre les académiciens et des jeunes médecins, chirurgiens, biologistes, scientifiques, pharmaciens, vétérinaires. Il réunit ainsi 38 jeunes scientifiques, dont 15...
lire plus