Dans un article publié dans la revue Nature Communications, l’équipe dirigée par Agnès Lehuen de l’Institut Cochin (Université Paris Cité / CNRS / Inserm) démontre l’importance du rôle des cellules MAIT (Mucosal Associated Invariant T cells) dans l’inflammation chronique du tissu adipeux et la dysbiose intestinale dans un contexte d’obésité.
Les résultats mettent en lumière les mécanismes immunitaires impliqués dans le développement du diabète de type 2 lors de l’obésité et désignent les cellules MAIT comme nouvelles cibles thérapeutiques potentielles dans l’obésité et le diabète de type 2.
© Amine Toubal/Agnès Lehuen
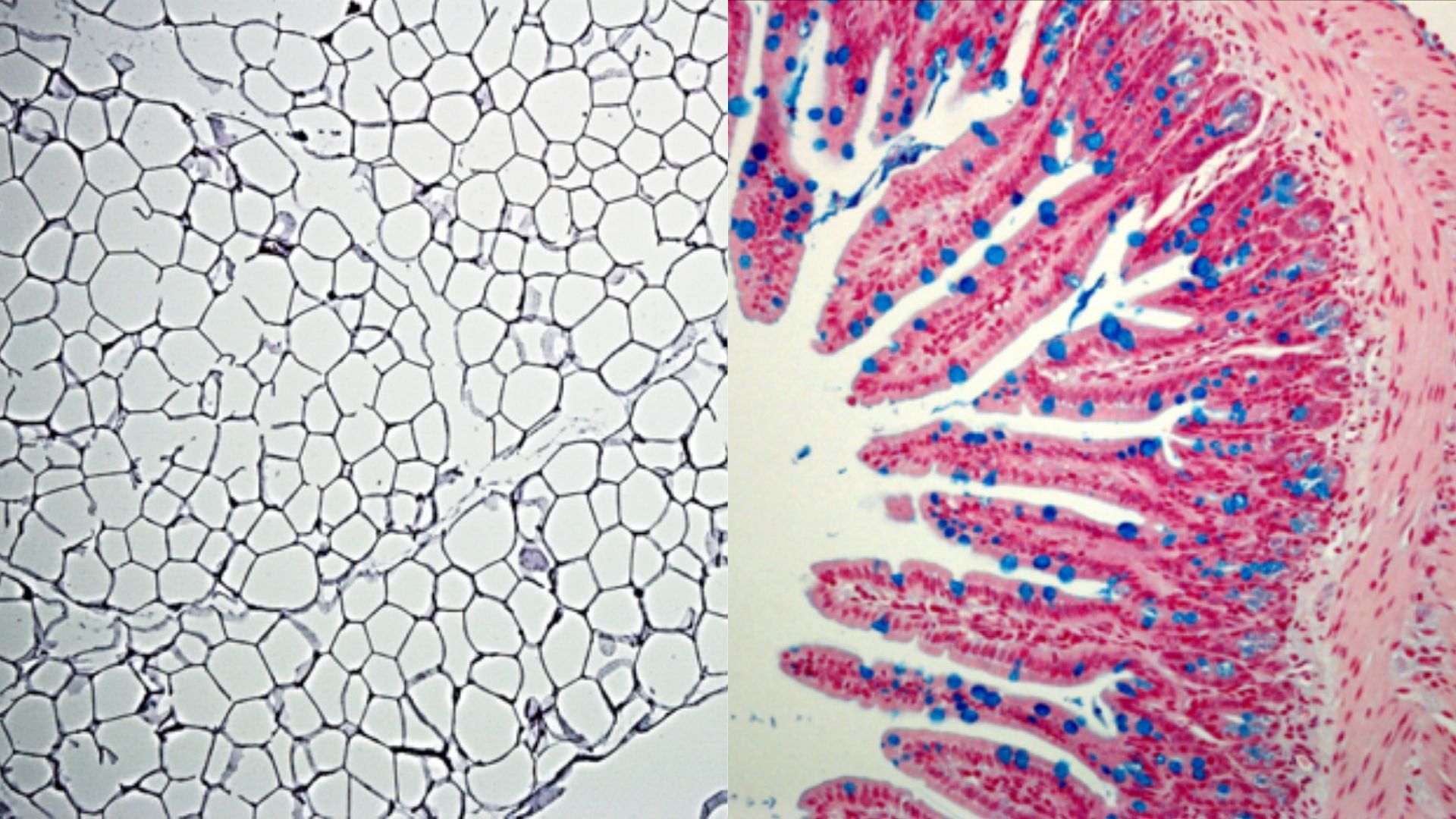
L’obésité est une pathologie avec une composante inflammatoire dont la prévalence ne cesse d’augmenter dans le monde. Les cellules immunitaires jouent un rôle important dans le développement de cette maladie et notamment dans le tissu adipeux avec la mise en place d’une inflammation chronique. Les cellules MAIT sont des lymphocytes T non-conventionnels, restreints par la molécule non-polymorphe MR1, présentant des métabolites bactériens dérivés de la vitamine B2 ou riboflavine. Ces cellules ont la capacité de produire des cytokines dont l’IL-2, l’IFN-γ, le TNF α , l’IL-17 et le granzyme B. Dans une étude antérieure, l’équipe avait décrit une dérégulation des cellules MAIT dans le sang et le tissu adipeux de sujets obèses et/ou diabétiques, montrant que les cellules MAIT représentaient un biomarqueur du développement du diabète mais sans déterminer si les altérations des cellules MAIT étaient la conséquence ou la cause des dysfonctions métaboliques associées à l’obésité et au diabète de type 2. Cette nouvelle étude à l’aide de modèles murins met en évidence le rôle délétère des cellules MAIT dans l’obésité et le développement du diabète de type 2.
Les auteurs ont observé dans plusieurs modèles murins d’obésité (génétique et nutritionnel) des altérations du phénotype et de la fonction des cellules MAIT dans le tissu adipeux similaires à celles observées chez les patients. Ces altérations ont également été observées au niveau de l’intestin (iléon) mais pas dans d’autres organes. Le rôle des cellules MAIT dans l’obésité a donc été analysé, en étudiant des souris transgéniques possédant un nombre accru de cellules MAIT ou à l’opposé des souris dépourvues en cellules MAIT, toutes les souris étant nourries par un régime riche en graisse. Les souris exprimant un grand nombre de cellules MAIT développent une inflammation dans le tissu adipeux et l’iléon, une insulino-résistance et une altération du métabolisme du glucose et des lipides. A l’inverse, l’absence des cellules MAIT diminue l’inflammation de ces tissus et améliore les paramètres métaboliques. Au niveau de l’intestin les cellules MAIT participent à la dysbiose (déséquilibre du microbiote intestinal) et à la perte de l’intégrité de la barrière intestinale. Ces altérations tissulaires contribuent au dysfonctionnement métabolique.
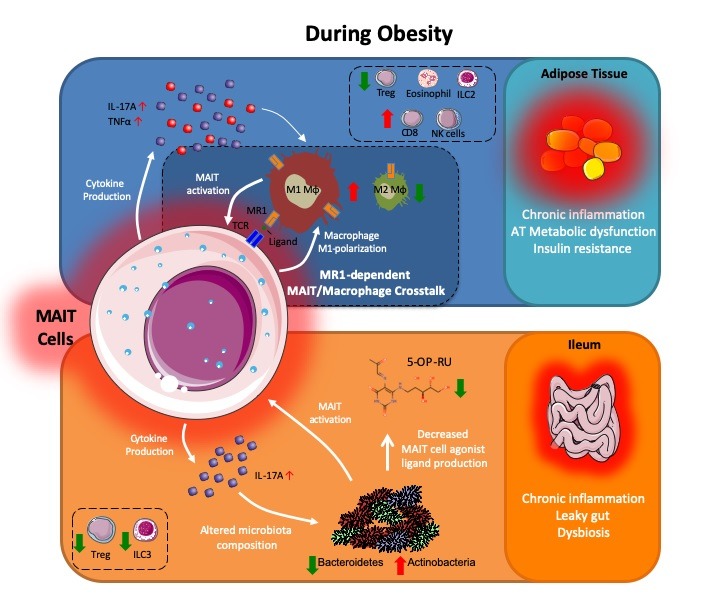
Figure : Les cellules MAIT induisent une inflammation du tissu adipeux et de l’iléon et une dysbiose induisant le développement d’une insulino-résistance et d’un diabète de type 2 (© Amine Toubal/Agnès Lehuen/Servier Medical Art)
Le mécanisme inflammatoire des cellules MAIT induit la modification des autres cellules immunitaires du tissu adipeux et de l’iléon. Dans l’obésité, les cellules MAIT favorisent la polarisation des macrophages en type M1 (pro-inflammatoires) et cette polarisation résulte d’une interaction directe entre les cellules MAIT et les macrophages. Chez les souris obèses, l’injection de ligand bloquant cette interaction entre les cellules MAIT et les macrophages diminue l’inflammation du tissu adipeux, la dysbiose intestinale et les dysfonctions métaboliques.
Ces résultats suggèrent que les cellules MAIT pourraient représenter une nouvelle cible thérapeutique pour le traitement de l’obésité et du diabète de type 2.
Contact chercheuse :
Agnès Lehuen
chercheuse CNRS
+33176535590
Institut Cochin (Université Paris Cité/Inserm/CNRS)
22 rue Méchain, 75014 Paris
En savoir plus :
Mucosal-Associated Invariant T cells promote inflammation and intestinal dysbiosis leading to metabolic dysfunction during obesity. Toubal A*, Kiaf B*, Beaudoin L, Cagninacci L, Rhimi M, Fruchet B, da Silva J, Corbett A, Simoni Y, Lantz O, Rossjohn J, McCluskey J, Lesnik P, Maguin E, Lehuen A. Nat Commun. July 2020 doi : 10.1038/s41467-020-17307-0
À lire aussi
Journée mondiale contre le cancer : une mobilisation collective de la Faculté de Santé

Abraha et Pierre : une amitié au service de la mémoire des peuples en temps de guerre
À Paris, les chemins de deux historiens se croisent. L’un arrive d’Éthiopie, portant avec lui des carnets remplis d’observations quotidiennes rédigées pendant la guerre du Tigré. L’autre, français, est spécialiste de l’histoire contemporaine éthiopienne. De cette...
Le rôle clé de la communication intestin-cerveau dans le circuit de la récompense
Menée par Oriane Onimus, doctorante soutenue par la Fondation pour la Recherche Médicale, et dirigée par Giuseppe Gangarossa, professeur à l'Université Paris Cité, une étude publiée le 30 janvier 2026 dans la revue Science Advances révèle que les mécanismes de la...

Prédire le risque d’infection chez le nouveau-né grâce au microbiote vaginal
Sous la coordination du Pr Laurent Mandelbrot (Université Paris Cité), chef du service de gynécologie-obstétrique de l’hôpital Louis-Mourier AP-HP, des équipes de l’AP-HP, de l’Université Paris Cité, de l’Université Sorbonne Paris Nord, de l’Inserm, de l’Institut...
