Des chercheurs de l’Institut Pasteur et du Vaccine Research Institute, en collaboration avec la KU Leuven (Leuven, Belgique), le CHR d’Orléans, l’Hôpital Européen Georges Pompidou (AP-HP), l’Inserm et le CNRS, ont étudié la sensibilité du variant Omicron aux anticorps monoclonaux utilisés en clinique pour prévenir les formes graves de la maladie chez les personnes à risque, ainsi qu’aux anticorps présents dans le sang de personnes vaccinées ou ayant déjà été infectées par le SARS-CoV-2. Ils ont comparé cette sensibilité avec celle du variant Delta. Les chercheurs ont montré qu’Omicron est beaucoup moins sensible aux anticorps neutralisants que Delta. Les chercheurs ont ensuite analysé le sang de personnes ayant reçu deux doses du vaccin Pfizer ou du vaccin AstraZeneca. Cinq mois après vaccination, les anticorps présents dans le sang ne sont plus capables de neutraliser Omicron. Cette perte d’efficacité est également observée chez les personnes infectées par le SARS-CoV-2 dans les 12 mois précédents. Une troisième dose de rappel avec le vaccin Pfizer, ou l’injection d’une dose de vaccin chez les personnes ayant fait antérieurement une infection, augmente fortement les taux d’anticorps, à un niveau suffisant pour neutraliser Omicron. Omicron est donc particulièrement peu sensible aux anticorps anti-SARS-CoV-2 actuellement utilisés en clinique ou obtenus après deux doses de vaccin.
Le variant Omicron a été détecté pour la première fois en Afrique du Sud en Novembre 2021 et a depuis diffusé dans de nombreux pays. Il est estimé qu’il sera prédominant en quelques semaines ou mois.
Les premières études épidémiologiques montrent une transmissibilité accrue du variant Omicron par rapport au variant Delta. On ne connaît encore que peu de choses des caractéristiques biologiques du variant Omicron. Il comprend plus de 32 mutations dans la protéine Spike, par rapport au premier SARS-CoV-2, et a été désigné « Variant of Concern » ou « Variant d’Inquiétude » par l’OMS le 26 novembre 2021.
En Afrique du Sud, le variant Omicron a remplacé les autres virus en quelques semaines et est responsable d’une forte montée du nombre de cas diagnostiqués. Des analyses dans différents pays indiquent que le temps de doublement des cas est d’environ 2 à 4 jours. Plus de 10.000 cas ont par exemple été répertoriés en Angleterre au 15 décembre 2021, où il devrait être majoritaire à la fin de l’année 2021.
En France, 347 cas de variant Omicron ont été diagnostiqués au 17 décembre 2021 selon Santé publique France, mais il est estimé que ce nombre va rapidement augmenter.
Dans une nouvelle étude soutenue par l’Union Européenne (Health Emergency Preparedness and Response Authority, HERA), des chercheurs de l’Institut Pasteur et du Vaccine Research Institute en collaboration avec la KU Leuven (Leuven, Belgique), le CHR d’Orléans, l’Hôpital Européen Georges Pompidou (AP-HP) et l’Inserm, ont étudié la sensibilité du variant Omicron aux anticorps, par rapport au variant Delta, actuellement majoritaire. L’objectif de cette étude était de caractériser la capacité des anticorps thérapeutiques, ainsi que ceux développés par les personnes ayant été précédemment infectées par le SARS-CoV-2 ou ayant été vaccinées, à neutraliser ce nouveau variant.
Les chercheurs de la KU Leuven ont isolé le variant Omicron du SARS-CoV-2 à partir d’un échantillon nasal d’une femme de 32 ans, ayant développé un COVID-19 modéré quelques jours après son retour d’Egypte. Le virus isolé a pu être rapidement transmis aux chercheurs de l’Institut Pasteur, où les anticorps monoclonaux thérapeutiques, les sérums de personnes ayant été exposées précédemment au SARS-CoV-2 ou ayant été vaccinées, ont été utilisés pour étudier la sensibilité du variant Omicron.
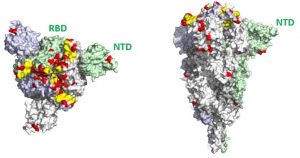
Visualisation 3D des mutations de la Spike du variant Omicron. (Gauche : vue de dessus. Droite : vue latérale). Les mutations sont indiquées en rouge. Elles sont présentes sur toute la protéine Spike, mais s’accumulent au niveau de la zone de liaison au récepteur (Receptor Binding Domain ou RBD) et dans une région appelée N-terminal Domain (NTD). © Institut Pasteur – Félix Rey
Sur cette souche infectieuse isolée du virus Omicron, les chercheurs ont utilisé des tests rapides de neutralisation, mis au point par l’unité Virus et Immunité de l’Institut Pasteur. Ce travail collaboratif et multidisciplinaire associe également des spécialistes de l’analyse de l’évolution virale, de la structure des protéines et des virologistes de l’Institut Pasteur, avec des équipes hospitalières d’Orléans et l’Hôpital Européen Georges Pompidou (AP-HP).
Les chercheurs ont d’abord testé neuf anticorps monoclonaux utilisés en clinique ou en phase de développement préclinique. Six anticorps perdent totalement leur activité antivirale, et les trois autres sont de 3 à 80 fois moins efficaces contre Omicron par rapport à Delta. Les anticorps Bamlanivimab/Etesevimab (combinaison développée par Lilly), Casirivimab/ Imdevimab (combinaison développée par Roche et appelée Ronaprève), Regdanvimab (développé par Celtrion) perdent totalement leur effet antiviral contre Omicron. La combinaison Tixagevimab/Cilgavimab (développée par AstraZeneca sous le nom de Evusheld) est 80 fois moins efficace contre Omicron que contre Delta.
« Nous montrons que ce variant très transmissible, a acquis une résistance marquée aux anticorps. Les anticorps monoclonaux thérapeutiques anti-SARS-CoV-2 disponibles actuellement sont pour la plupart inactifs » commente Olivier Schwartz, co-principal auteur de l’étude et directeur de l’unité Virus et Immunité à l’Institut Pasteur.
Les scientifiques constatent que le sang de patients ayant eu un COVID-19, recueilli jusqu’à 12 mois après les symptômes, ainsi que des personnes ayant reçu les deux doses du vaccin Pfizer ou du vaccin AstraZeneca ne neutralisent quasiment plus le variant Omicron, cinq mois après la vaccination. En revanche, les sérums d’individus ayant reçu une 3e dose de rappel Pfizer, analysés un mois après injection, restent efficaces contre Omicron. Il faut cependant de 5 à 31 fois plus d’anticorps pour neutraliser Omicron, en comparaison avec Delta, dans les tests de culture cellulaire. Ces résultats permettent de comprendre comment les vaccins restent efficaces pour protéger contre les formes sévères de la maladie.
« Il est nécessaire maintenant d’étudier la durée de protection de la 3e dose de rappel. Les vaccins perdent donc probablement une forte efficacité contre l’acquisition du virus, mais devraient continuer à protéger contre les formes graves » précise Olivier Schwartz, co-principal auteur de l’étude et directeur de l’unité Virus et Immunité à l’Institut Pasteur.
« Cette étude montre que le variant Omicron met l’efficacité des vaccins et des anticorps monoclonaux à l’épreuve, mais démontre aussi la capacité des chercheurs européens à se mettre en réseau pour mieux cerner les défis et les pistes de solutions dont nous disposons. Alors que la KU Leuven a pu décrire le premier cas d’infection à Omicron en Europe grâce au système de surveillance génomique mis en place en Belgique, notre collaboration avec l’Institut Pasteur à Paris nous a permis de réaliser cette étude dans un temps record. Il reste encore beaucoup de travail, mais nous sommes clairement rentrés dans une phase où, grâce au soutien de l’Union Européenne (Health Emergency Preparedness and Response Authority, HERA), les chercheurs des meilleurs centres peuvent travailler en synergie et avancer vers une phase où cette pandémie pourra être mieux comprise et mieux maîtrisée » commente Emmanuel André, co-principal auteur de l’étude et professeur de médecine à la KU Leuven (Université Catholique de Louvain), responsable du laboratoire de référence et du réseau de surveillance génomique pour le COVID-19 en Belgique.
Les chercheurs concluent que les nombreuses mutations présentes dans la protéine Spike du variant Omicron lui permettent d’échapper en grande partie à la réponse du système immunitaire. Les études en cours ont pour objectif de comprendre pourquoi ce variant est plus transmissible d’un individu à l’autre et d’analyser l’efficacité de la 3e dose sur le long terme.
Références
Considerable escape of SARS-CoV-2 variant Omicron to antibody neutralization, bioRxiv, 16 décembre 2021
Delphine Planas1,2*, Nell Saunders1,3*, Piet Maes4*, Florence Guivel-Benhassine1, Cyril Planchais5, Julian Buchrieser1, William-Henry Bolland1,3, Françoise Porrot1, Isabelle Staropoli1, Frederic Lemoine6, Hélène Péré7,8, David Veyer7,8, Julien Puech7, Julien Rodary7, Guy Baele4, Simon Dellicour4,9, Joren Raymenants10, Sarah Gorissen10, Caspar Geenen10, Bert Vanmechelen4, Tony Wawina -Bokalanga4, Joan Martí-Carreras4, Lize Cuypers11, Aymeric Sève12, Laurent Hocqueloux12, Thierry Prazuck12, Félix Rey13, Etienne Simon-Lorrière14, Timothée Bruel1,2,$, Hugo Mouquet5,$, Emmanuel André10,11,$ and Olivier Schwartz1,2,$
- Institut Pasteur, Université Paris Cité, CNRS UMR3569, Virus and Immunity Unit, 75015 Paris, France
- Vaccine Research Institute, 94000 Créteil, France
- Université Paris Cité, École doctorale BioSPC 562, 75013 Paris, France
- KU Leuven, Rega Institute, Department of Microbiology, Immunology and Transplantation, Laboratory of Clinical and Epidemiological Virology, Leuven, Belgium
- Institut Pasteur, Université Paris Cité, INSERM U1222, Humoral Immunology Laboratory, 75015 Paris, France
- Institut Pasteur, Université Paris Cité, CNRS USR 3756, Hub de Bioinformatique et Biostatistique, 75015 Paris, France.
- Hôpital Européen Georges Pompidou, Laboratoire de Virologie, Service de Microbiologie, 75015 Paris, France
- Centre de Recherche des Cordelier, INSERM, Université Paris Cité, Sorbonne Université, Functional Genomics of Solid Tumors (FunGeST), 75006 Paris, France
- Université Libre de Bruxelles, Spatial Epidemiology Lab (SpELL), Bruxelles, Belgium
- KU Leuven, Department of Microbiology, Immunology and Transplantation, Laboratory Clinical Microbiology, Leuven, Belgium
- University Hospitals Leuven, Department of Laboratory Medicine, National Reference Centre for Respiratory Pathogens, Leuven, Belgium
- CHR d’Orléans, service de maladies infectieuses, Orléans, France
- Institut Pasteur, Université Paris Cité, CNRS UMR3569, Structural Virology Unit, 75015 Paris, France
- Institut Pasteur, Université Paris Cité, CNRS UMR3569, G5 Evolutionary genomics of RNA viruses, 75015 Paris, France
*: co-first authors
$: co-last authors
À lire aussi

La semaine du cerveau 2026 à l’Université Paris Cité

Prix Jeunes Talents France L’Oréal-UNESCO Pour les Femmes et la Science : Appel à candidatures 2026
La Fondation L'Oréal, en partenariat avec la Commission nationale française pour l'UNESCO et l'Académie des sciences, déclare officiellement ouvert l'appel à candidatures de l'édition 2026 du Prix Jeunes Talents France L'Oréal-UNESCO Pour les Femmes et la Science :...

Suivi des maladies chroniques : un patient sur deux serait ouvert à la téléconsultation
L’étude REACTIVE, coordonnée par la Dre Tiphaine Lenfant et le Pr Viet-Thi Tran et menée par des équipes de médecine interne de l’hôpital européen Georges-Pompidou AP-HP, du centre d’épidémiologie clinique de l’hôpital Hôtel-Dieu AP-HP, de l’Université Paris Cité, de...

Le Collège de l’Académie nationale de médecine : une première promotion marquée par l’engagement de l’Université Paris Cité
Créé en décembre 2023, le Collège de l’Académie nationale de médecine se veut être un lieu d’échanges entre les académiciens et des jeunes médecins, chirurgiens, biologistes, scientifiques, pharmaciens, vétérinaires. Il réunit ainsi 38 jeunes scientifiques, dont 15...
