Certaines souches « hypervirulentes » de Listeria monocytogenes ont une capacité accrue à infecter le système nerveux central. Des scientifiques de l’Institut Pasteur, d’Université Paris Cité, de l’Inserm et de l’AP-HP ont décrit un mécanisme qui permet aux cellules infectées par Listeria monocytogenes de survivre à l’action du système immunitaire. Les cellules infectées circulant dans le sang ont ainsi une probabilité accrue d’adhérer aux cellules de la paroi des vaisseaux cérébraux et de les infecter à leur tour. Ceci permet aux bactéries de traverser la barrière hématoencéphalique et d’atteindre le cerveau. Cette étude est publiée dans Nature, le 16 mars 2022.
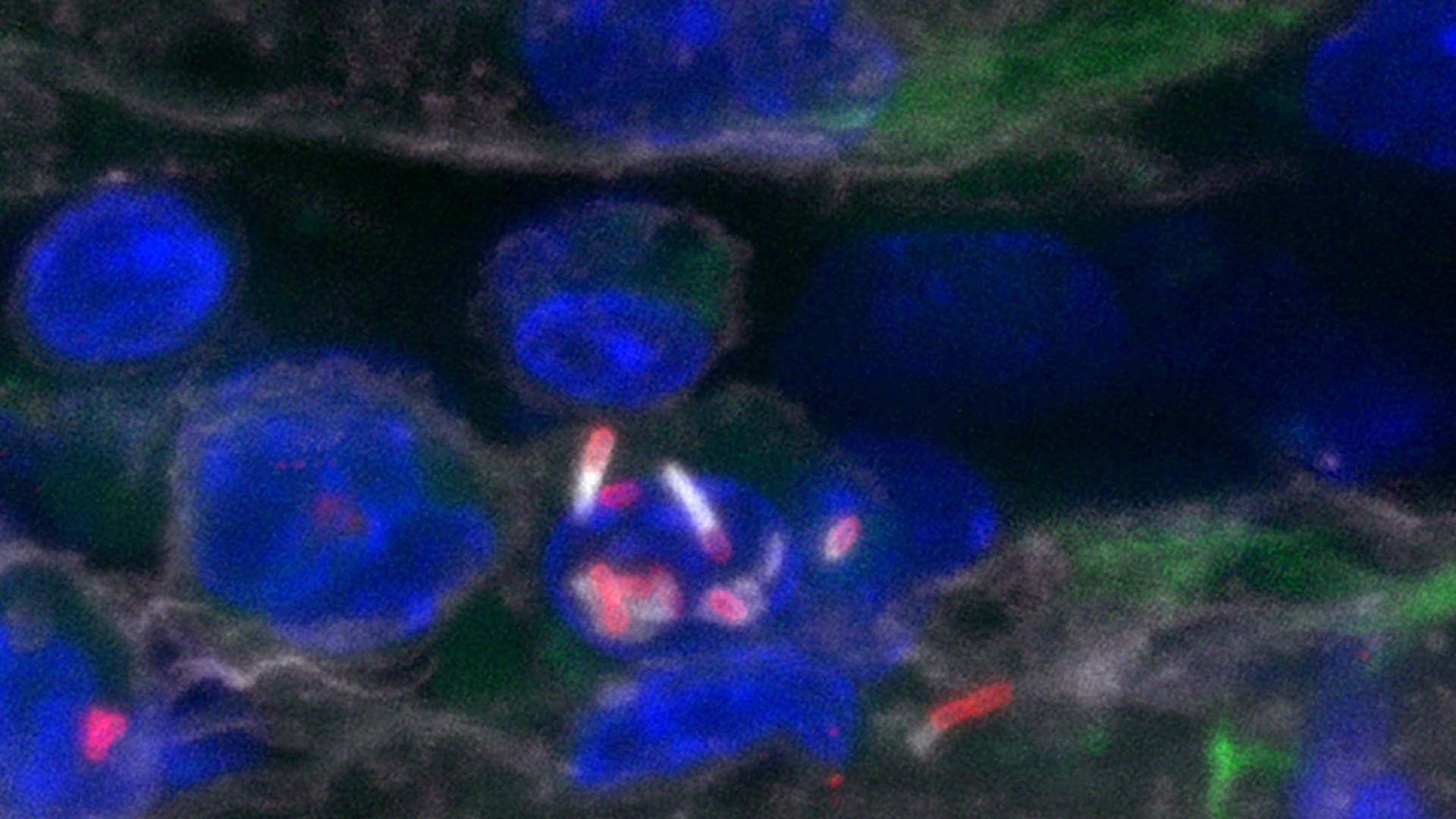
Section d’un vaisseau cérébral de modèle animal infecté, contenant des monocytes infectés adhérant aux cellules endothéliales. Listeria est marquée en rouge, l’actine en blanc (y compris les comètes d’actine propulsant Listeria), les noyaux en bleu et les macrophages en vert.
© Unité de Biologie des infections – Institut Pasteur
Le système nerveux central est séparé du sang par une barrière physiologique appelée barrière hématoencéphalique, qu’il est difficile de traverser. Pourtant, certains pathogènes y parviennent et infectent ainsi le système nerveux central, par des mécanismes encore mal connus.
Listeria monocytogenes est la bactérie responsable de la listériose humaine, une infection grave d’origine alimentaire, qui peut se traduire par une atteinte du système nerveux central appelée neurolistériose. Cette infection du système nerveux central est particulièrement grave et conduit au décès dans 30% des cas.
Les chercheurs de l’unité de Biologie des infections à l’Institut Pasteur (Université Paris Cité, Inserm) et du Centre National de Référence et Centre Collaborateur OMS Listeria dirigés par Marc Lecuit (Université Paris Cité et hôpital Necker-Enfants malades AP-HP) ont découvert, dans un modèle animal qui reproduit les différentes étapes de la listériose humaine, le mécanisme qui permet à Listeria monocytogenes d’infecter le système nerveux central. Pour cela, ils ont mis au point un modèle expérimental cliniquement pertinent, impliquant des souches virulentes de Listeria[1] issues de patients atteints de neurolistériose.
Les scientifiques ont tout d’abord observé qu’un type de globules blancs, appelés monocytes inflammatoires, sont infectés par la bactérie. Ces monocytes infectés circulent par voie sanguine et adhèrent aux parois des vaisseaux cérébraux, permettant à Listeria d’infecter le tissu cérébral.
L’équipe de recherche a ensuite montré qu’InlB, une protéine de surface de Listeria monocytogenes, permet à la bactérie d’échapper au système immunitaire et de survivre dans la niche protectrice que constitue le monocyte infecté. En effet, l’interaction entre la protéine InlB et son récepteur cellulaire c-Met entraîne le blocage de la mort cellulaire induite par les lymphocytes T cytotoxiques ciblant spécifiquement les cellules infectées par Listeria. Grâce à InlB, les cellules infectées peuvent donc survivre aux lymphocytes T cytotoxiques.
Ce mécanisme permet de prolonger la durée de vie des cellules infectées, ce qui se traduit par une augmentation du nombre de monocytes infectés dans le sang et favorise la propagation de la bactérie aux tissus de l’hôte, dont le cerveau. Cette propriété favorise également la persistance de Listeria dans le tissu intestinal, son excrétion fécale et sa transmission à l’environnement.
« Nous avons découvert un mécanisme spécifique et inattendu, par lequel un pathogène augmente la durée de vie des cellules qu’il infecte, en bloquant spécifiquement une fonction du système immunitaire essentielle au contrôle de l’infection », explique Marc Lecuit (Université Paris Cité et hôpital Necker-Enfants malades AP-HP), responsable de l’unité de Biologie des infections à l’Institut Pasteur (Université Paris Cité, Inserm).
Il est possible que des mécanismes similaires favorisent l’infection du cerveau par d’autres pathogènes intracellulaires tels que Toxoplasma gondii et Mycobacterium tuberculosis. De plus, l’identification et la compréhension des mécanismes d’échappement immunitaire des cellules infectées pourrait conduire au développement de nouvelles stratégies thérapeutiques anti-infectieuses, ainsi qu’au développement de nouvelles approches immunosuppressives chez les patients recevant une greffe d’organe.
Ces travaux ont été financés par l’Institut Pasteur, l’Inserm et le Conseil européen de la recherche (ERC), et bénéficient d’un financement de la Fondation Le Roch – Les Mousquetaires.
[1] Uncovering Listeria monocytogenes hypervirulence by harnessing its biodiversity, Nature Genetics, 1er février 2016
Communiqué de presse : https://www.pasteur.fr/fr/listeria-souches-hypervirulentes-tropisme-cerebral-placentaire
Références
Bacterial inhibition of Fas-mediated killing promotes neuroinvasion and persistence, Nature, 16 mars 2022
Claire Maudet1, Marouane Kheloufi1, Sylvain Levallois1, Julien Gaillard1, Lei Huang1, Charlotte Gaultier1, Yu-Huan Tsai1,‡, Olivier Disson1, Marc Lecuit1,2,3
- Institut Pasteur, Université Paris Cité, Inserm U1117, Biology of Infection Unit, 75015 Paris, France
- Institut Pasteur, National Reference Center and WHO Collaborating Center Listeria, 75015 Paris, France
- Necker-Enfants Malades University Hospital, Division of Infectious Diseases and Tropical Medicine, APHP, Institut Imagine, 75006, Paris, France
DOI : 10.1038/s41586-022-04505-7
À lire aussi

La semaine du cerveau 2026 à l’Université Paris Cité

Prix Jeunes Talents France L’Oréal-UNESCO Pour les Femmes et la Science : Appel à candidatures 2026
La Fondation L'Oréal, en partenariat avec la Commission nationale française pour l'UNESCO et l'Académie des sciences, déclare officiellement ouvert l'appel à candidatures de l'édition 2026 du Prix Jeunes Talents France L'Oréal-UNESCO Pour les Femmes et la Science :...

Suivi des maladies chroniques : un patient sur deux serait ouvert à la téléconsultation
L’étude REACTIVE, coordonnée par la Dre Tiphaine Lenfant et le Pr Viet-Thi Tran et menée par des équipes de médecine interne de l’hôpital européen Georges-Pompidou AP-HP, du centre d’épidémiologie clinique de l’hôpital Hôtel-Dieu AP-HP, de l’Université Paris Cité, de...

Le Collège de l’Académie nationale de médecine : une première promotion marquée par l’engagement de l’Université Paris Cité
Créé en décembre 2024, le Collège de l’Académie nationale de médecine se veut être un lieu d’échanges entre les académiciens et des jeunes médecins, chirurgiens, biologistes, scientifiques, pharmaciens, vétérinaires. Il réunit ainsi 38 jeunes scientifiques, dont 15...
