La maladie de Charcot-Marie Tooth est la maladie neurologique héréditaire la plus fréquente au monde. Elle touche le nerf périphérique et entraine une paralysie progressive des jambes et des mains. Aucun traitement n’est aujourd’hui disponible pour lutter contre cette maladie, due à la surexpression d’une protéine spécifique. Des scientifiques du CNRS, de l’Inserm, de l’AP-HP et des universités de Paris et Paris-Saclay ont mis au point, chez la souris, une thérapie fondée sur la dégradation de l’ARN codant pour cette protéine.
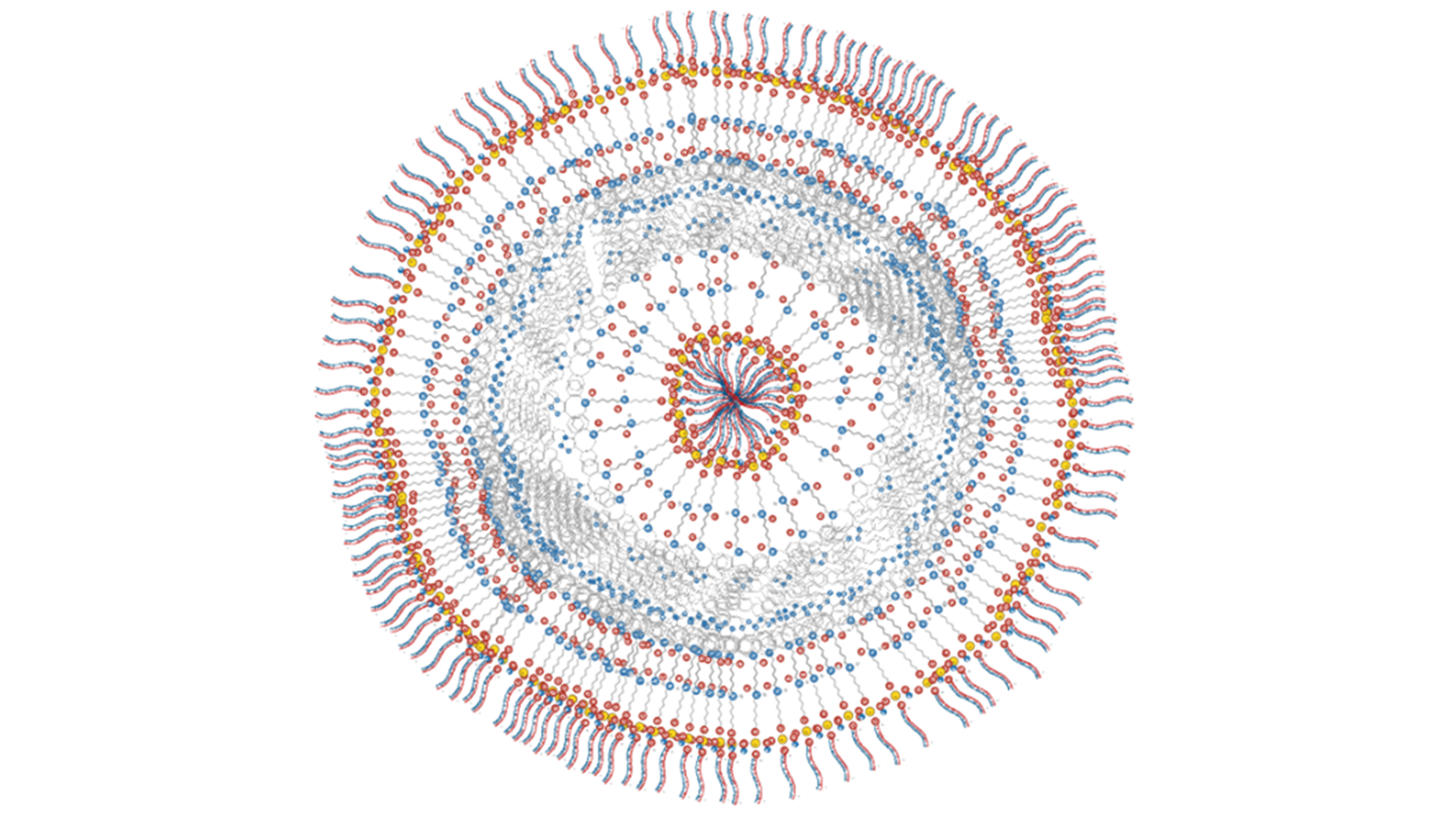
© Liliane Massade, laboratoire Maladies et hormones du système nerveux (Inserm/Université Paris-Saclay)
En biologie moléculaire, la transcription correspond à la copie d’une molécule d’ADN en une molécule d’ARN. Cette molécule d’ARN est ensuite « traduite » en une protéine, qui peut assurer différentes fonctions au sein des cellules de l’organisme. Lorsque qu’une protéine particulière, appelée PMP22, est fabriquée en quantité deux fois plus importante que la normale, elle provoque le développement de la maladie génétique Charcot-Marie Tooth de type 1A. Cette surproduction entraine une paralysie progressive des jambes et des mains.
Tout l’enjeu est donc de réussir à normaliser l’expression de cette protéine chez les personnes atteintes de la maladie de Charcot-Marie Tooth. Pour cela, des scientifiques français1 ont mis au point une thérapie, brevetée2, fondée sur la dégradation de l’ARN codant pour la protéine PMP22. Ils ont utilisé à cette fin d’autres petits ARN capables d’interférer avec un ARN spécifique, ici celui codant pour la PMP22, et de conduire à sa dégradation ou à la diminution de sa traduction en protéine.
La difficulté pour la mise au point de cette thérapie a été de stabiliser ces petits ARN, dit interférents (ou siARN), qui se dégradent très rapidement dans l’environnement biologique. Les chercheuses et chercheurs les ont couplés avec une autre molécule, le squalène, classiquement utilisée en cosmétologie ou en pharmacologie. Biocompatible, biodégradable et formant dans l’eau des nanoparticules, le squalène protège les siARN de toute dégradation. Il permet également de contrôler la taille des particules formées et la quantité de siARN injectée.
Les scientifiques ont ensuite montré, sur des souris modèles de cette maladie, que l’injection de ces ARN interférents permettait la restitution complète et rapide de l’activité locomotrice et de la force des souris. Les siARN pénètrent dans les nerfs périphériques, renforcent la couche de myéline3 autour de ces nerfs et normalisent la vitesse du signal nerveux. L’effet du traitement perdure trois semaines pour les formes graves et plus de dix semaines pour les formes plus légères de la maladie.
Cette stratégie thérapeutique pour les neuropathies périphériques héréditaires, entièrement mise au point en France, constitue la preuve de concept d’une nouvelle médecine de précision fondée sur la normalisation par siARN de l’expression d’un gène surexprimé. Elle reste à développer chez l’humain avec des études pré-cliniques et cliniques.

1 Au laboratoire Maladies et hormones du système nerveux (Inserm/Université Paris-Saclay), au laboratoire Aspects métaboliques et systémiques de l’oncogénèse pour de nouvelles approches thérapeutiques (CNRS/Université Paris-Saclay/Institut Gustave Roussy), à l’Institut Galien Paris-Saclay (CNRS/Université Paris-Saclay), au Service de neurologie – centre de référence neuropathies périphériques rares du CHU de Limoges, au Service de neurologie – centre de référence national des neuropathies amyloïdes familiales et autres neuropathies périphériques rares du CHU du Kremlin-Bicêtre (AP-HP/Université Paris-Saclay) et au laboratoire Environmental, toxicity, therapeutic targets, cellular signaling ans biomarkers (Inserm/Université Paris Cité). Ces travaux ont bénéficié du financement de l’ANR dans le cadre du programme Avenir (Labex NanoSaclay, référence ANR-10-LABX-0035).
2 Références : WO/2020/064749, PCT/EP2019/075736
3 La myéline est une couche riche en lipides qui isole les axones des neurones et permet la transmission accrue du signal nerveux. Des dysfonctionnements de la myéline entrainent des maladies du nerf très invalidantes. La protéine PMP22 est présente dans la myéline et elle est essentielle pour le fonctionnement du nerf.
Référence : Squalenoyl siRNA PMP22 nanoparticles are effective in treating mouse models of Charcot Marie-Tooth disease type 1A. Suzan Boutary, Marie Caillaud, Mévidette El Madani, Jean-Michel Vallat, Julien Loisel Duwattez, Alice Rouyer, Laurence Richard, Céline Gracia, Giorgia Urbinati, Didier Desmaële, Andoni Echaniz-Laguna, David Adams, Patrick Couvreur, Michael Schumacher, Charbel Massaad, Liliane Massaad-Massade.
Le 9 mars 2021, Communications Biology. DOI : 10.1038/s42003-021-01839-2
À lire aussi
Prix des meilleurs mémoires de la Graduate School Sustainability, Organisations and Institutions : valoriser l’excellence scientifique en soutenabilité
La Graduate school Sustainability, Organisations and Institutions a organisé sa traditionnelle cérémonie de remise de Prix des meilleurs mémoires de ses étudiantes et étudiants. Une distinction valorisant l’excellence scientifique des recherches consacrées au développement durable et à la soutenabilité. Découvrez les trois lauréates et lauréats récompensés pour la qualité de leurs travaux.

La semaine du cerveau 2026 à l’Université Paris Cité

Prix Jeunes Talents France L’Oréal-UNESCO Pour les Femmes et la Science : Appel à candidatures 2026
La Fondation L'Oréal, en partenariat avec la Commission nationale française pour l'UNESCO et l'Académie des sciences, déclare officiellement ouvert l'appel à candidatures de l'édition 2026 du Prix Jeunes Talents France L'Oréal-UNESCO Pour les Femmes et la Science :...

Suivi des maladies chroniques : un patient sur deux serait ouvert à la téléconsultation
L’étude REACTIVE, coordonnée par la Dre Tiphaine Lenfant et le Pr Viet-Thi Tran et menée par des équipes de médecine interne de l’hôpital européen Georges-Pompidou AP-HP, du centre d’épidémiologie clinique de l’hôpital Hôtel-Dieu AP-HP, de l’Université Paris Cité, de...
