Près de 20% des cancers sont associés à des infections microbiennes. Si les mécanismes en jeu sont assez bien connus concernant les virus et bactéries, le rôle que jouent les parasites recèle encore beaucoup de mystères. Une nouvelle étude du laboratoire Épigénétique et Destin Cellulaire, dirigé par le Pr Jonathan Weitzman, s’est intéressée à Theileria annulata, un parasite transmis à la vache par les tiques, qui provoque une maladie semblable au cancer et tue l’animal en quelques jours. Cette étude, publiée dans Nature Communications, décrit une modification d’une enzyme qui permet au parasite de réguler l’expression de ses gènes, mécanisme qui n’avait jamais été signalé chez les mammifères.
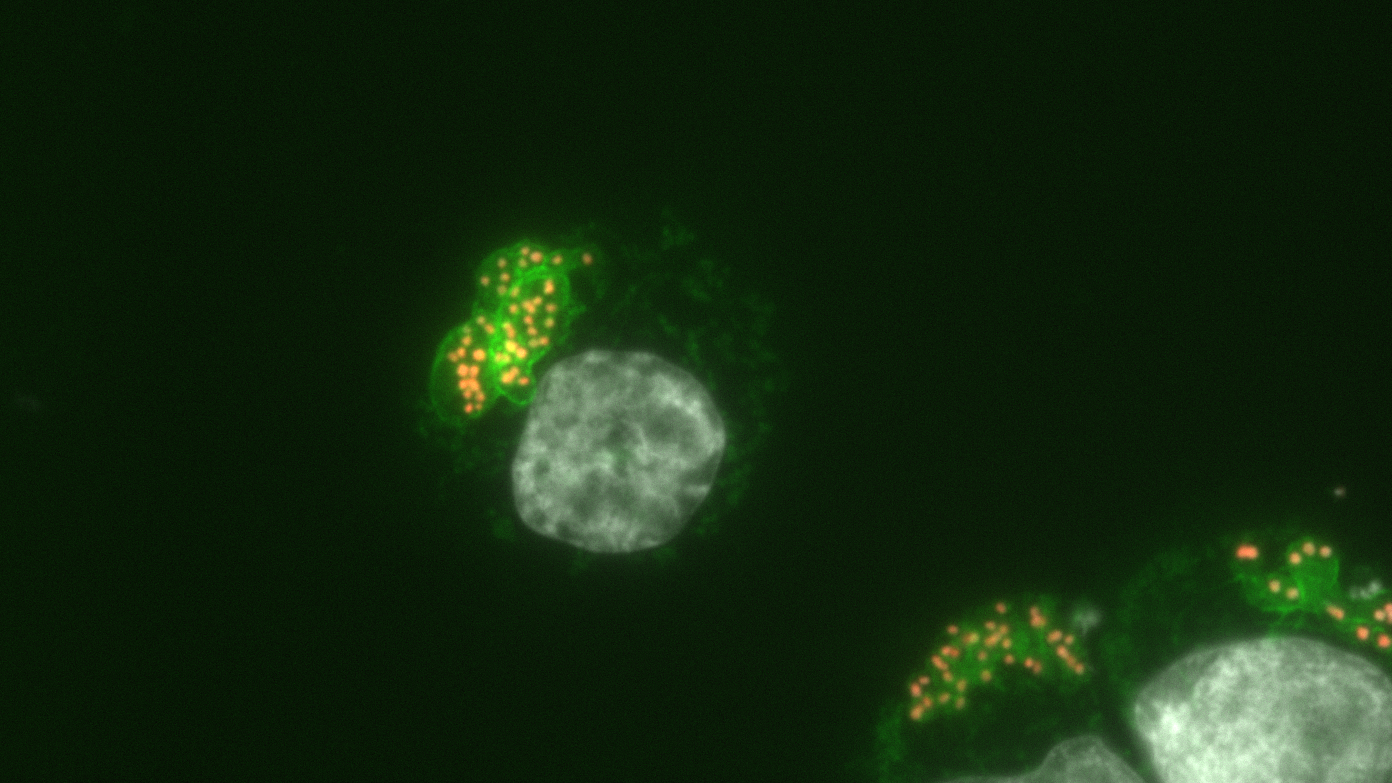
Macrophages bovins infectés par Theileria annulata.
La fluorescence verte met en évidence la surface du parasite.
Les noyaux parasitaires sont recouverts de la nouvelle marque épigénétique (appelée H3K18me, en orange) mais le noyau de la cellule hôte bovine est dépourvu de cette marque (en gris).
© Laboratoire Épigénétique et Destin Cellulaire
Les parasites unicellulaires sont peut-être des organismes minuscules, mais ils sont responsables de certaines des pires maladies au monde, chez l’homme comme chez les animaux. Une meilleure connaissance du fonctionnement de ces parasites et de ce qui les rend uniques est un défi majeur pour développer des médicaments et vaccins efficaces.
Theileria annulata, parasite unicellulaire, provoque une maladie mortelle chez les bovins en Afrique et en Asie, avec un impact socio-économique très conséquent. Si un médicament existe bien pour lutter contre ce parasite, le traitement devient inefficace dès lors que ce parasite subit une mutation génétique le rendant résistant au traitement. Il est donc important de comprendre le comportement singulier de Theileria annulata pour ouvrir de nouvelles pistes thérapeutiques.
Tout en s’appuyant sur les mêmes outils moléculaires de génomique et de biochimie, l’étude conduite par l’équipe du Pr Jonathan Weitzman s’écarte des modèles expérimentaux classiques en génétique et se penche sur les mécanismes épigénétiques en jeu dans l’infection par ce parasite.
Theileria annulata : un ennemi insoupçonné
Transmis à la vache par les tiques, ce parasite infecte les globules blancs, se multiplie au même rythme que ses hôtes et les rend, tout comme des cellules cancéreuses, « immortels ». En étudiant cette maladie du bétail, les chercheurs ont donc exploré les mécanismes particuliers semblables à ceux impliqués dans une maladie à la fois génétique et épigénétique1 : le cancer.
Dans une précédente étude, publiée en 2015 dans Nature, l’équipe du Pr Jonathan Weitzman avait décrit le mécanisme par lequel Theileria annulata rend la cellule hôte, le globule blanc, « immortelle ». L’équipe avait démontré que le parasite secrète une protéine qui modifie l’identité génétique des globules blancs au point qu’ils commencent à se répliquer de façon anarchique, ce qui les rend « immortels » de façon semblable à ce qui est observé pour les cellules cancéreuses. En se multipliant ainsi, ils permettent au parasite d’envahir peu à peu tous les organes, provoquant le décès de l’animal.
Dans une nouvelle étude, publiée le 28 mai 2021 dans Nature Communications , l’équipe a découvert un nouveau mécanisme épigénétique par lequel ce parasite arrive à réguler l’expression de ses propres gènes (l’utilisation ou non de ses gènes), de façon surprenante.
Un mécanisme encore jamais décrit chez les mammifères
À la différence des bactéries et virus, Theileria annulata est un parasite eucaryote. Comme les mammifères, ses cellules contiennent donc un noyau dans lequel se trouve l’ADN : séquence de gènes.
Les généticiens et biochimistes, membres de l’équipe, ont montré que Theileria annulata produit une enzyme (protéine), appelée enzyme épigénétique, qui lui permet de réguler l’expression de ses propres gènes. Ce mécanisme, encore jamais décrit chez les mammifères, est primordial pour la survie du parasite. Il pourrait donc être une clé pour explorer de nouvelles pistes thérapeutiques.
C’est incroyable que nous puissions encore apprendre beaucoup de choses sur la façon dont les gènes sont activés et désactivés en étudiant un minuscule organisme unicellulaire, s’émerveille le professeur J. Weitzman, ajoutant que c’est la première fois que l’épigénome de ces parasites est étudié à un tel niveau de détail moléculaire.
Cette découverte suggère que des médicaments capables de bloquer ce mécanisme de sécrétion d’enzyme épigénétique par le parasite, pourraient bloquer son cycle de vie et l’empêcher de se propager, d’abord aux tiques puis au bétail. Ces résultats permettent simultanément d’explorer un moyen intéressant de développer de nouveaux médicaments pour traiter ces infections à leur source, chez le parasite, sans provoquer d’effets secondaires chez leurs hôtes mammifères.
Cette étude a été financée avec le soutien de l’ANR et du Labex Who am I ?
Références
Dynamic methylation of histone H3K18 in differentiating Theileria parasites. Cheeseman K, Jannot G, Lourenço N, Villares M, Berthelet J, Calegari-Silva T, Hamroune J, Letourneur F, Rodrigues-Lima F, Weitzman JB.
DOI : https://doi.org/10.1038/s41467-021-23477-2
Theileria parasites secrete a prolyl isomerase to maintain host leukocyte transformation. Marsolier J, Perichon M, DeBarry JD, Villoutreix BO, Chluba J, Lopez T, Garrido C, Zhou XZ, Lu K, Fritsch L, Ait-Si-Ali S, Mhadhbi M, Medjkane S, Weitzman JB.
DOI : https://doi.org/10.1038/nature14044
Professeur Jonathan Weitzmann
Laboratoire Épigénétique et Destin cellulaire
UMR 7216 CNRS – Université Paris Cité
Membre senior de l’Institut Universitaire de France
[1] Si la génétique s’intéresse spécifiquement aux gènes, à leur séquence d’ADN, à leurs mutations potentielles… l’épigénétique explore les facteurs qui influencent l’utilisation ou non des gènes par la cellule, leur comportement. Contrairement aux mutations qui peuvent affecter la séquence d’ADN d’un ou plusieurs gènes, les modifications épigénétiques sont réversibles.
À lire aussi
Prix des meilleurs mémoires de la Graduate School Sustainability, Organisations and Institutions : valoriser l’excellence scientifique en soutenabilité
La Graduate school Sustainability, Organisations and Institutions a organisé sa traditionnelle cérémonie de remise de Prix des meilleurs mémoires de ses étudiantes et étudiants. Une distinction valorisant l’excellence scientifique des recherches consacrées au développement durable et à la soutenabilité. Découvrez les trois lauréates et lauréats récompensés pour la qualité de leurs travaux.

La semaine du cerveau 2026 à l’Université Paris Cité

Prix Jeunes Talents France L’Oréal-UNESCO Pour les Femmes et la Science : Appel à candidatures 2026
La Fondation L'Oréal, en partenariat avec la Commission nationale française pour l'UNESCO et l'Académie des sciences, déclare officiellement ouvert l'appel à candidatures de l'édition 2026 du Prix Jeunes Talents France L'Oréal-UNESCO Pour les Femmes et la Science :...

Suivi des maladies chroniques : un patient sur deux serait ouvert à la téléconsultation
L’étude REACTIVE, coordonnée par la Dre Tiphaine Lenfant et le Pr Viet-Thi Tran et menée par des équipes de médecine interne de l’hôpital européen Georges-Pompidou AP-HP, du centre d’épidémiologie clinique de l’hôpital Hôtel-Dieu AP-HP, de l’Université Paris Cité, de...
