L’équipe de recherche Cellules souches, Développement et Évolution, dirigée par le Pr Michel Vervoort à l’Institut Jacques Monod (UMR7592 CNRS – Université Paris Cité), s’est penchée sur les mécanismes qui contrôlent le processus de régénération du corps après une amputation. Bien que largement répandue chez les animaux, les mécanismes qui contrôlent ce processus fascinant sont néanmoins encore imparfaitement connus. Les résultats de leur étude, portant sur un ver marin possédant de fortes capacités de régénération, mettent en évidence le rôle important d’une modification de l’ADN.

Platynereis dumerilii
© Nicolas Dray – Institut Jacques Monod
Si les capacités de régénération sont limitées dans l’espèce humaine et chez les mammifères en général, de nombreux autres animaux sont capables de régénérer des structures complexes comme des membres, par exemple pattes ou nageoires. Certains organismes ont même la capacité extraordinaire de reformer la totalité de leur corps à partir d’un petit fragment de tissu ou même de quelques cellules.
L’équipe de recherche Cellules souches, Développement et Évolution s’intéresse tout particulièrement au processus de régénération observé chez un ver marin : Platynereis dumerilii. Le cycle de vie de ce lointain cousin du ver de terre intéresse les chercheurs à plus d’un titre. Grâce aux cellules souches contenues dans la partie postérieure de son corps, Platynereis dumerilii poursuit sa croissance toute sa vie durant (environ 2 ans) avant de se reproduire et de mourir. Mais plus surprenant encore, il possède des capacités de régénération[1] très importantes qui lui permettent de reformer, de manière très efficace, la partie postérieure de son corps, après une amputation de celle-ci, y compris des cellules souches qui lui permettent de croître. Percer le secret de cette régénération est devenu le défi de cette équipe de recherche.
Cellules souches ou reprogrammation cellulaire ?
Nous héritons tous d’un patrimoine génétique, nos gènes, que nous conservons toute notre vie. Ce patrimoine génétique est présent dans toutes nos cellules mais ne se manifeste pas de la même façon partout. Les cellules du cœur sont différentes de celles de la peau, du foie, du cerveau… et cette différence vient du fait que les gènes ne s’expriment pas (ne s’activent pas) tous, partout et en même temps. Dans les cellules de la peau, certains gènes s’expriment, d’autres pas. De même, dans les cellules du cœur, ce sont d’autres gènes qui s’expriment. Ces activations ou inactivations de gènes sont dues à des modifications de leur environnement.
Les cellules souches, quant à elles, sont des cellules très particulières car non spécialisées, (dites indifférenciées). Elles sont non seulement capables de s’auto-renouveler, donc de produire des cellules tout autant souches qu’elles-mêmes, mais également de se différencier en d’autres types de cellules spécialisées. Ces capacités d’auto-renouvellement et de différenciation expliquent le processus de croissance de Platynereis dumerilii. Mais, en cas d’amputation de sa partie postérieure, ces cellules souches sont éliminées. Ce ver marin va donc devoir régénérer sa partie terminale amputée qui contient les cellules souches postérieures, puis, grâce à ces dernières, il pourra reprendre sa croissance.
L’équipe de recherche Cellules souches, développement et évolution à l’Institut Jacques Monod a précédemment montré que, lors de la régénération de cet animal, les cellules voisines de la zone amputée, bien que spécialisées, sont capables de se modifier génétiquement pour « régresser » à un état cellulaire indifférencié, comparable à celui des cellules souches, et deviennent alors capables de générer des cellules différentes de celles pour lesquelles elles étaient génétiquement programmées initialement. C’est ce qu’on appelle la reprogrammation cellulaire.
Dans leur dernière publication (BMC Biology), les chercheurs ont montré que cette reprogrammation cellulaire à l’origine de la régénération de la partie amputée nécessite la fixation de molécules particulières appelées groupe méthyle au niveau des gènes via un processus nommé méthylation de l’ADN. En effet, la présence de ces groupes méthyle, en modifiant l’environnement des gènes, modifie leur activité et donc le fonctionnement de la cellule. Parallèlement, les chercheurs ont démontré que l’ajout d’un agent chimique déméthylant (ôtant les groupes méthyle), largement utilisé en cancérologie, bloque le processus de régénération. En revanche, dès que cet agent chimique déméthylant est retiré, la régénération cellulaire reprend, mais la croissance qui s’en suivra sera durablement perturbée et le ver présentera des malformations.
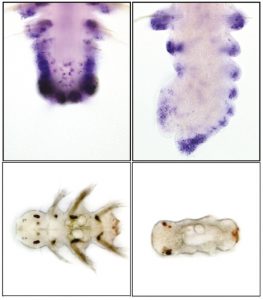
Le traitement des vers avec un agent déméthylant utilisé en cancérologie provoque des malformations au cours de la régénération (en haut) et du développement (en bas).
© Anabelle Planques, Pierrer Kerner, Eve Gazave, Michel Vervoort – Institut Jacques Monod
Et chez l’Homme ?
Mieux comprendre les mécanismes cellulaires et moléculaires de la régénération, outre son intérêt en recherche fondamentale, présente également un grand intérêt potentiel pour la médecine, notamment pour la médecine régénérative. Cette meilleure compréhension de la régénération est aussi indispensable au développement de nouveaux traitements ciblant des maladies dégénératives qui concernent généralement des organes ayant peu de capacité de régénération intrinsèque.
Les résultats de cette étude, en suggérant un rôle important de la méthylation de l’ADN dans la régénération cellulaire, ouvre de nouvelles perspectives pour mieux comprendre les mécanismes de contrôle de ce processus fascinant.
[1] Régénération : C’est le processus par lequel certaines espèces sont capables, après amputation, de former une masse de cellules indifférenciées qui ensuite se spécialisent pour reformer une structure et une fonction.
DNA methylation atlas and machinery in the developing and regenerating annelid Platynereis dumerilii – Anabelle Planques, Pierre Kerner, Laure Ferry, Christoph Grunau, Michel Vervoort
DOI : 10.1186/s12915-021-01074-5
Anabelle Planques – ATER, Université Paris Cité
Pierre Kerner – Maître de conférences, Université Paris Cité
Laure Ferry – Ingénieure d’étude, Université Paris Cité
Christoph Grunau – Professeur, Université de Perpignan Via Domitia
Eve Gazave – Chercheuse CNRS (Institut Jacques Monod)
Michel Vervoort – Professeur, Université Paris Cité (Institut Jacques Monod)
À lire aussi

La semaine du cerveau 2026 à l’Université Paris Cité

Prix Jeunes Talents France L’Oréal-UNESCO Pour les Femmes et la Science : Appel à candidatures 2026
La Fondation L'Oréal, en partenariat avec la Commission nationale française pour l'UNESCO et l'Académie des sciences, déclare officiellement ouvert l'appel à candidatures de l'édition 2026 du Prix Jeunes Talents France L'Oréal-UNESCO Pour les Femmes et la Science :...

Suivi des maladies chroniques : un patient sur deux serait ouvert à la téléconsultation
L’étude REACTIVE, coordonnée par la Dre Tiphaine Lenfant et le Pr Viet-Thi Tran et menée par des équipes de médecine interne de l’hôpital européen Georges-Pompidou AP-HP, du centre d’épidémiologie clinique de l’hôpital Hôtel-Dieu AP-HP, de l’Université Paris Cité, de...

Le Collège de l’Académie nationale de médecine : une première promotion marquée par l’engagement de l’Université Paris Cité
Créé en décembre 2024, le Collège de l’Académie nationale de médecine se veut être un lieu d’échanges entre les académiciens et des jeunes médecins, chirurgiens, biologistes, scientifiques, pharmaciens, vétérinaires. Il réunit ainsi 38 jeunes scientifiques, dont 15...
