Thérapies ciblées : biofabrication de vecteurs de médicaments
© G.Lavieu
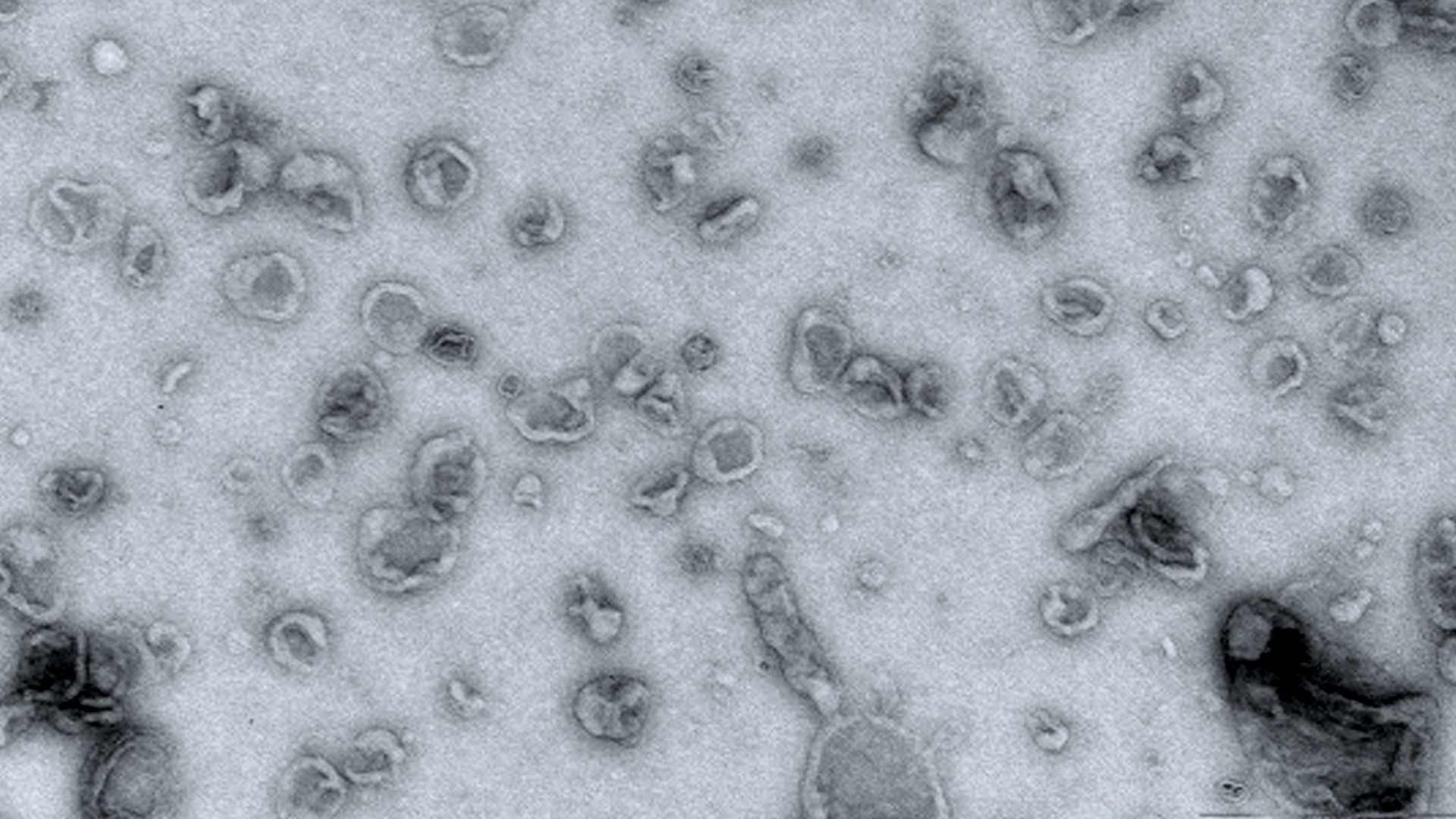
Vésicules extracellulaires observées en microscopie électronique.
Dans deux récentes publications, Grégory Lavieu, titulaire de la chaire d’Excellence IdEx-Université Paris Cité, Shéryl Bui et Julia Dancourt, chercheuses dans son groupe de recherche (UMR7057 CNRS – Université Paris Cité – Inserm U1316,) ont mis au point des procédés de biofabrication de cellules capables de produire des vésicules extracellulaires dédiées au transport et à l’administration d’agents thérapeutiques dans des cellules receveuses d’intérêts, notamment des cellules cancéreuses
. Ce nouveau procédé ne faisant intervenir aucun composant viral, habituellement utilisé dans la fabrication des vecteurs, permet de s’affranchir de contraintes de fabrications et risques sanitaires. Cette découverte ouvre de larges perspectives dans le domaine de l’administration d’agents thérapeutiques via des vésicules extracellulaires modifiées qui pourraient être intégrées aux protocoles de thérapies cellulaires et géniques.
Connues depuis une trentaine d’années, les vésicules extracellulaires sont de petits sacs vésiculaires produits par les cellules et capables de transporter diverses molécules hors de la cellule. Présentes dans tous les fluides corporels, ces vésicules extracellulaires (VE) ont longtemps été considérées comme de simples transporteurs chargés d’évacuer les déchets produits par la cellule. Dans de précédentes études, l’équipe de recherche avait démontré que les VE servaient à transporter différents biomatériaux (protéines, acides nucléiques…) d’une cellule donneuse à une cellule receveuse. Elle avait alors explicité et quantifié ce processus de relargage du contenu vésiculaire mettant ainsi en avant le potentiel que ces VE représentaient pour leur utilisation comme vecteurs de médicaments. Ces vésicules servant d’enveloppes aux principe actifs des médicaments et les acheminant directement sur les cellules malades, elles permettent ainsi d’éviter une dispersion de médicament dans l’organisme et les effets secondaires associés, ce qui révolutionnerait les thérapies cellulaires et géniques.
Poursuivant ses investigations, l’équipe de recherche conduite par G. Lavieu, caractérise pas à pas ces mécanismes de transport et de relargage au niveau cellulaire et moléculaire.
Cherchant à utiliser les propriétés naturelles des cellules donneuses, l’équipe s’est demandée s’il serait possible de biofabriquer des cellules donneuses produisant des VE aux propriétés particulières.
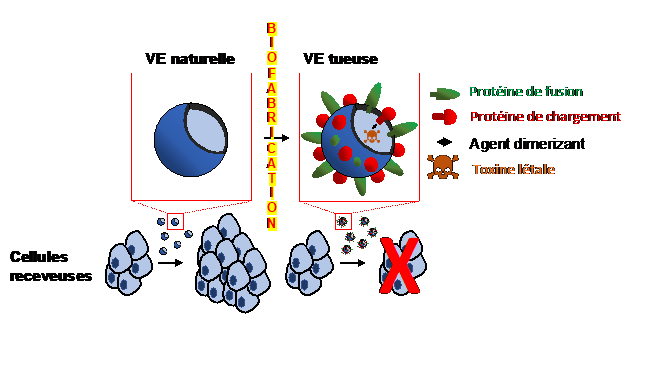
Biofabrication de vésicules tueuses chargées d’une toxine létale et décorées de protéines de fusion non-virales permettant d’augmenter l’administration de la toxine dans les cellules receveuses conduit à l’élimination de ces mêmes cellules. À terme, ces vésicules tueuses pourraient compléter l’arsenal thérapeutique permettant les ablations tumorales.
L’objectif étant de créer des vecteurs de médicament dans le cadre de thérapies ciblées, les chercheurs ont procédé par étape.
La première d’entre elles a consisté à biofabriquer, grâce à des outils génétiques, des cellules donneuses capables de produire une toxine létale (protéine capable de bloquer la synthèse protéique dans les cellules), tout en rendant ces cellules donneuses résistantes à cette toxine.
Les chercheurs ont ensuite mis au point une technique permettant de charger cette toxine (ou tout autre protéine d’intérêt) dans ces vésicules extracellulaires, de façon réversible. Parallèlement, les VE ont été équipées avec une molécule fusogénique d’origine humaine, permettant d’augmenter la fusion des membranes et donc le déversement du contenu vésiculaire dans les cellules receveuses. Habituellement l’agent fusogénique est d’origine virale, ce qui impose de nombreuses contraintes de production et risques sanitaires. Une fois ces VE fusogéniques produites par les cellules donneuses et chargées avec la toxine létale, les chercheurs ont récolté les VE et les ont mises en contact avec des cellules receveuses en culture. Les VE ont alors fusionné avec les cellules donneuses et déverser leur contenu vésiculaire (toxine) dans les cellules receveuses ce qui a provoqué la mort de ces dernières.
Ces découvertes et mises au point de nouveaux procédés de biofabrication permettent une avancée considérable dans le domaine du développement des thérapies ciblées, notamment dans le cas des cancers. La méthode est versatile et permet de charger un large spectre de protéines thérapeutiques et promet de compléter l’arsenal des thérapies cellulaire et géniques.
Références
1- Efficient cell death mediated by bioengineered killer extracellular vesicles Julia Dancourt, Ester Piovesana & Gregory Lavieu
https://www.nature.com/articles/s41598-023-28306-8
2- Virus-Free Method to Control and Enhance Extracellular Vesicle Cargo Loading and Delivery Sheryl Bui, Julia Dancourt, Gregory
À lire aussi
Prix des meilleurs mémoires de la Graduate School Sustainability, Organisations and Institutions : valoriser l’excellence scientifique en soutenabilité
La Graduate school Sustainability, Organisations and Institutions a organisé sa traditionnelle cérémonie de remise de Prix des meilleurs mémoires de ses étudiantes et étudiants. Une distinction valorisant l’excellence scientifique des recherches consacrées au développement durable et à la soutenabilité. Découvrez les trois lauréates et lauréats récompensés pour la qualité de leurs travaux.
lire plus
La semaine du cerveau 2026 à l’Université Paris Cité

Prix Jeunes Talents France L’Oréal-UNESCO Pour les Femmes et la Science : Appel à candidatures 2026
La Fondation L'Oréal, en partenariat avec la Commission nationale française pour l'UNESCO et l'Académie des sciences, déclare officiellement ouvert l'appel à candidatures de l'édition 2026 du Prix Jeunes Talents France L'Oréal-UNESCO Pour les Femmes et la Science :...
lire plus
Suivi des maladies chroniques : un patient sur deux serait ouvert à la téléconsultation
L’étude REACTIVE, coordonnée par la Dre Tiphaine Lenfant et le Pr Viet-Thi Tran et menée par des équipes de médecine interne de l’hôpital européen Georges-Pompidou AP-HP, du centre d’épidémiologie clinique de l’hôpital Hôtel-Dieu AP-HP, de l’Université Paris Cité, de...
lire plus