Des chercheurs de l’Université Paris Cité, de l’Inserm, du Collège de France, du CNRS, de l’Institut Pasteur et de l’AP-HP apportent des éléments de réponse expliquant la prédisposition du nouveau-né à faire des méningites à Streptocoque du groupe B. Ils ont identifié et démontré que les récepteurs d’une protéine bactérienne permettant le franchissement de la barrière hémato-encéphalique[1] étaient surexprimés chez le nouveau-né et absents chez l’adulte.
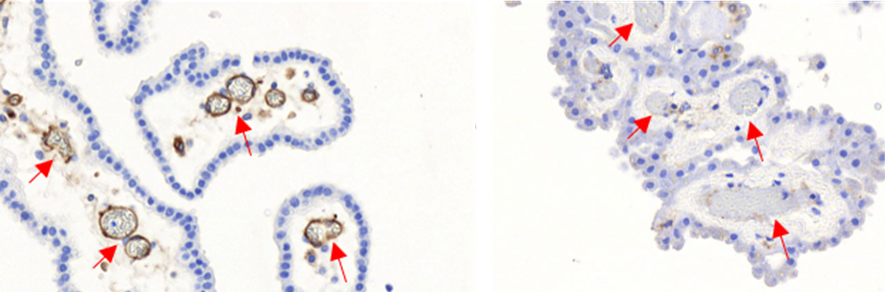
Coupe de cerveaux humains montrant l’expression d’un récepteur du Streptocoque de groupe B au niveau des vaisseaux sanguins cérébraux (flèches rouges) chez le nouveau-né, à gauche (marquage marron) et l’absence d’expression chez l’adulte, à droite (absence de marquage marron).
© Inserm
Chaque année à travers le monde, des milliers de nourrissons sont affectés par les méningites à streptocoques du groupe B. Souvent mortelle, la maladie peut aussi entraîner de lourdes séquelles chez les bébés qui survivent. Les adultes sont néanmoins épargnés par ce type de méningite.
Les streptocoques du groupe B sont présents dans le microbiote vaginal de 20 à 30 % des femmes. Pour éviter l’infection du nouveau-né au moment de la naissance, qui pourrait entrainer une septicémie et dans les cas les plus graves, une méningite, de nombreux pays développés, dont la France, ont mis en place un dépistage vaginal quelques semaines avant l’accouchement. Les femmes porteuses de streptocoques du groupe B reçoivent dans ce cas des antibiotiques au moment de l’accouchement.
Cette stratégie a permis de réduire fortement l’incidence des infections à streptocoques du groupe B survenant durant la première semaine de vie mais n’a eu aucun effet sur celles survenant entre 1 semaine et 3 mois de vie.
Par ailleurs, dans de nombreux pays du monde, aucun dépistage prénatal n’est proposé, et de nombreux bébés décèdent après la naissance d’une méningite à streptocoque du groupe B. Il s’agit donc d’un problème majeur de santé publique.
Prédisposition des nourrissons
Pour mieux comprendre la maladie et améliorer la prise en charge des mères et des enfants, la chercheuse Inserm Julie Guignot et son groupe de recherche à l’Institut Cochin (Inserm/CNRS/Université Paris Cité)[2] ont cherché à comprendre ce qui prédispose les nourrissons à cette maladie, alors que les enfants et les adultes ne sont qu’exceptionnellement concernés par ce type de méningite.
Dans de précédents travaux, les scientifiques avaient montré qu’un variant de streptocoque du groupe B était responsable de plus de 80 % des cas de méningites chez le nouveau-né. Ce variant exprime à sa surface des protéines spécifiques qui jouent un rôle essentiel dans le franchissement de la barrière hémato-encéphalique qui sépare le sang du cerveau.
Par des approches complémentaires, les chercheurs ont démontré qu’une des protéines exclusivement exprimées par ce variant reconnaissait de manière spécifique deux récepteurs présents dans les vaisseaux sanguins cérébraux qui constituent l’élément principal de la barrière hémato-encéphalique. Grâce à des prélèvements humains, ils ont démontré que ces récepteurs sont surexprimés chez les nouveau-nés. Ces récepteurs cérébraux ne sont en revanche pas présents chez l’adulte, ce qui explique que le streptocoque du groupe B n’est que très rarement responsable de méningites au-delà de la première année de vie, les bactéries ne pouvant atteindre le cerveau.
Grâce à des modèles animaux de méningite, les chercheurs ont confirmé leurs résultats, montrant que l’expression de ces récepteurs durant la période post-natale contribuait à la susceptibilité du nouveau-né à la méningite due au variant de streptocoque du groupe B.
Pour les chercheurs, ces résultats ouvrent des pistes thérapeutiques intéressantes. « L’idée serait de développer des traitements qui ciblent ces récepteurs au niveau de la barrière hémato-encéphalique. A plus long terme, nous aimerions étudier les facteurs de susceptibilité individuels conduisant au développement de ces infections. Ceci permettrait de réaliser un suivi personnalisé des nourrissons à risque nés de mère colonisée par ce variant », explique Julie Guignot.
[1] Barrière physiologique entre le sang et le cerveau qui protège ce dernier des substances toxiques et des micro-organismes pathogènes
[2] Le laboratoire Biologie moléculaire structurale et processus infectieux (CNRS/Institut Pasteur), le Centre interdisciplinaire de recherche en biologie (CNRS/Collège de France/INSERM), l’Institut pour l’avancée des biosciences (CNRS/INSERM/UGA), entre autres, ont également participé à ces travaux.
À lire aussi

La semaine du cerveau 2026 à l’Université Paris Cité

Prix Jeunes Talents France L’Oréal-UNESCO Pour les Femmes et la Science : Appel à candidatures 2026
La Fondation L'Oréal, en partenariat avec la Commission nationale française pour l'UNESCO et l'Académie des sciences, déclare officiellement ouvert l'appel à candidatures de l'édition 2026 du Prix Jeunes Talents France L'Oréal-UNESCO Pour les Femmes et la Science :...

Suivi des maladies chroniques : un patient sur deux serait ouvert à la téléconsultation
L’étude REACTIVE, coordonnée par la Dre Tiphaine Lenfant et le Pr Viet-Thi Tran et menée par des équipes de médecine interne de l’hôpital européen Georges-Pompidou AP-HP, du centre d’épidémiologie clinique de l’hôpital Hôtel-Dieu AP-HP, de l’Université Paris Cité, de...

Le Collège de l’Académie nationale de médecine : une première promotion marquée par l’engagement de l’Université Paris Cité
Créé en décembre 2023, le Collège de l’Académie nationale de médecine se veut être un lieu d’échanges entre les académiciens et des jeunes médecins, chirurgiens, biologistes, scientifiques, pharmaciens, vétérinaires. Il réunit ainsi 38 jeunes scientifiques, dont 15...
